ВВЕДЕНИЕ
Хроническая сердечная недостаточность (ХСН) в сочетании с хронической обструктивной болезнью легких (ХОБЛ) – часто встречающиеся заболевания в клинической практике врача-терапевта. Смертность при коморбидном течении ХСН и ХОБЛ остается высокой и с каждым годом увеличивается. Основной причиной летальности в этом случае выступают сердечно-сосудистые осложнения [1, 2].
Высокая сердечно-сосудистая смертность таких коморбидных пациентов может быть обусловлена взаимоотягощающими патологическими изменениями, происходящими на уровне вегетативной регуляции как у пациентов с ХСН, так и ХОБЛ [3–5].
Как при ХСН, так и при ХОБЛ наблюдается перестройка работы вегетативной нервной системы в сторону преобладания симпатического отдела нервной регуляции и снижения активности парасимпатического отдела [5].
При ХСН повышенная активность симпатической нервной системы сопровождается формированием спазма сосудистого русла и увеличением нагрузки на сердце, усилением ишемии и гипертрофии миокарда [4, 6]. У пациентов с ХОБЛ функциональные изменения вегетативной модуляции сердца характеризуются снижением вариабельности сердечного ритма, повышением частоты сердечных сокращений в покое, снижением чувствительности барорефлексов, нарушением восстановления частоты сердечных сокращений после физической нагрузки, что и обусловливает смертность больных с ХОБЛ [7, 8]. Сочетанная активация симпатической нервной системы у пациентов с ХСН и ХОБЛ может приводить к развитию злокачественных аритмий и возникновению внезапной сердечной смерти [3, 5, 9, 10]. В настоящее время вегетативная нервная система рассматривается как терапевтическая мишень как при ХСН [11], так и ХОБЛ [12].
Одним из лекарственных препаратов, который мог бы оказать благоприятное вегетонормализующее влияние у этой категории коморбидных пациентов, является цитопротектор, антигипоксант и антиоксидант мельдоний (оригинальный препарат Милдронат®), продемонстрировавший свою эффективность и безопасность в терапии пациентов с ХСН и ХОБЛ [13–20].
Вегетонормализующее действие препарата Милдронат® ранее было показано у пациентов с ХСН [13, 21–25], в том числе в сочетании с сахарным диабетом 2-го типа и автономной кардиальной нейропатией [26]. Вместе с тем изучение влияния мельдония на показатели состояния вегетативной нервной системы у пациентов с ХСН и ХОБЛ в доступной нам литературе мы не нашли.
Цель исследования – изучить влияние мельдония в составе комбинированной терапии на показатели вариабельности ритма сердца у пациентов с ХСН и ХОБЛ.
МАТЕРИАЛ И МЕТОДЫ
В рандомизированном исследовании приняли участие 60 пациентов, средний возраст 45–70 лет. У всех участников диагностировали ХСН II А стадии, II–III функционального класса (в соответствии с клиническими рекомендациями Российского кардиологического общества, Общества специалистов по сердечной недостаточности, 2020 г.) и ХОБЛ I–III степени ограничения воздушного потока (согласно классификации GОLD 2021 г.) вне обострения. Все пациенты перенесли инфаркт миокарда давностью от года до пяти лет.
Исследование было одобрено региональным этическим комитетом ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава России (протокол № 193-2014).
Критериями исключения из исследования были стенокардия напряжения III–IV функционального класса (ФК), фибрилляция предсердий и другие гемодинамически значимые нарушения ритма сердца, неконтролируемая злокачественная артериальная гипертензия, стойкая артериальная гипотензия, декомпенсированная ХСН, непереносимость применяемого в этом исследовании препарата, тяжелые неврологические и психические расстройства, клинически выраженная печеночная и почечная недостаточность, тяжелая эндокринная патология, социально незащищенные группы лиц (военнослужащие, беременные и кормящие женщины и т.д.), пациенты, участвующие в других клинических исследованиях в течение последнего месяца, невозможность или нежелание пациента выполнять условия исследования.
Участники были разделены на 2 группы: 1-я группа (основная, n=30) пациентов с ХСН и ХОБЛ получала в дополнение к базисной терапии мельдоний (Милдронат®) в дозе 1000 мг/сут, 2-я (контроль n=30) находилась исключительно на терапии базисными препаратами ХСН и ХОБЛ. Пациенты наблюдались в течение 12 нед.
Изучаемые группы пациентов были сопоставимы по основным клинико-демографическим характеристикам, степени тяжести ХСН и ХОБЛ, а также по дозам лекарственных препаратов, применяемых в связи с ХСН и ХОБЛ (эналаприл 5–20 мг, бисопролол 5–10 мг, торасемид 2,5–10 мг, спиронолактон 25–50 мг, ацетилсалициловая кислота 100 мг, олодатерола гидрохлорид/тиотропия бромид 2,5 мкг/2,5 мкг/сут или тиотропия бромид 0,0225 мг/сут). Клинико-демографическая характеристика больных, включенных в исследование, представлена в таблице 1.
В начале исследования и через 12 нед терапии изучалась динамика показателей, характеризующих течение ХСН и ХОБЛ. Исследовались ФК ХСН, дистанция, пройденная пациентами при проведении теста 6-минутной ходьбы (ТШХ), количество набранных баллов по шкале ШОКС. Концентрацию N-концевого фрагмента мозгового натрийуретического пептида (NT-proBNP) в крови оценивали с помощью иммуноферментного анализа (NT-proBNP, Bio-medica, Slovakia). Результаты выражались в фмоль/мл.
Параметры функции внешнего дыхания (ФВД) определялись по общепринятой методике на аппарате SPIROSOFT FUKUDA 3000 (Япония).
Степень насыщения крови кислородом (SpO2) изучалась посредством лазерной допплеровской флоуметрии (ЛДФ) со спектральным анализом колебаний кровотока с помощью аппарата «ЛАКК-ОП» (Россия).
Динамика основных параметров вариабельности ритма сердца (ВРС) оценивалась при помощи программного модуля «Поли-Спектр-Ритм (Поли-Спектр-8/Е» (Россия). Исследовались кратковременные (5-минутные) записи электрокардиограммы в положении пациента лежа на спине [27–29].
Временнoй анализ проводился по следующим показателям: SDNN – стандартное отклонение всех анализируемых интервалов R–R; pNN50 (%) – процентное соотношение последовательных интервалов NN; RMSSD (мс) – квадратный корень из среднего квадратов разностей величин последовательных пар интервалов NN. По динамике показателей RMSSD и pNN50 определялись изменения влияния парасимпатического отдела нервной регуляции. Напряженность регуляторных систем оценивалась по величине следующих параметров: (SI) – стресс-индекс и ИН – индекс напряженности [30]. Спектральный анализ применялся для определения вклада периодических составляющих в изменения частоты сердечных сокращений (ЧСС): ТР – суммарная мощность спектра ВРС; LF/HF – коэффициент вагосимпатического баланса; VLF %, LF %, HF % (очень низкочастотный, низкочастотный и высокочастотный компоненты варибельности в процентах от суммарной мощности колебаний) [28]. В зависимости от величины ИН (в положении лежа на спине) выделяли следующие типы вегетативного тонуса: ваготония, эйтония, симпатикотония, гиперсимпатикотония [30].
Статистическая обработка данных выполнялась с использованием программы STATISTICA 10.0. Полученные результаты представлены в виде Me [Q25; Q75], где Me – медиана, а Q25 и Q75 – процентили соответственно; качественные показатели приведены в виде частоты встречаемости (%). Сравнение параметров двух независимых выборок по количественному показателю производилось с помощью критерия Манна–Уитни. Анализ полученных результатов до и после лечения в каждой группе осуществлялся по критерию Вилкоксона. Качественные признаки оценивались с использованием точного метода Фишера.
РЕЗУЛЬТАТЫ
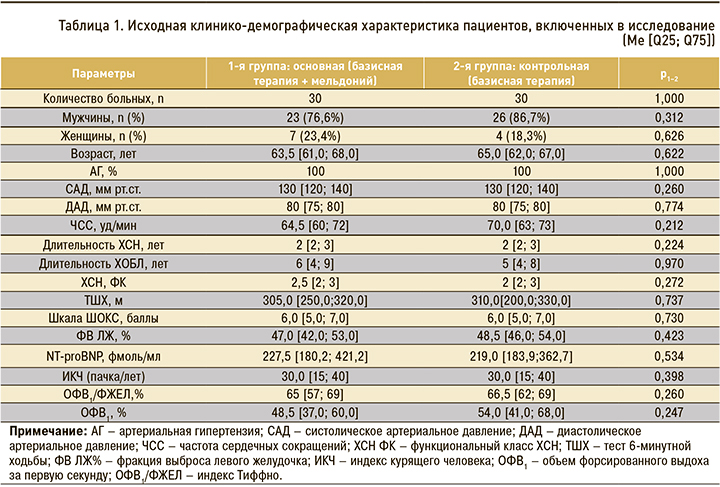
При анализе показателей ВРС в основной группе больных отмечалось достоверное увеличение показателя SDNNфон – на 20,5% (36,5% исходно против 44,0% на фоне терапии) в сравнении с группой контроля, где прирост SDNNфон составил 3,0% (33,0% исходно против 34,0% после терапии); разница между группами по конечным точкам была достоверной (р=0,035). Процент частоты встречаемости SDNNфон <50 в основной группе больных статистически значимо снизился на 16,7% (70,0% исходно против 53,3% через 12 нед терапии) в сопоставлении с группой контроля, где достоверных изменений не наблюдалось (80,0% исходно против 76,6% через 12 нед терапии).
На фоне терапии с включением мельдония в основной группе пациентов определялся статистически значимый рост показателя ТРфон на 39,5% (1369,0 мс2 исходно против 1910,0 мс2 через 12 нед терапии) относительно группы контроля, где ТРфон повысился на 5,5% (1085,0 мс2 исходно против 1145,0 мс2 через 12 нед терапии). Также в основной группе пациентов было установлено достоверное снижение показателя (SI)фон на 38,0% (218,3 у.е. исходно против 135,3 у.е. через 12 нед терапии) в сравнении с группой контроля, где значимых изменений не отмечалось, и (SI фон уменьшился на 13,5% (208,9 у.е. исходно против 180,5 у.е. на фоне терапии). Было выявлено снижение ИН на 30,4% в группе пациентов ХСН и ХОБЛ, получавших в дополнение к базисной терапии мельдоний (115,8 против 80,5 у.е.), при сопоставлении с группой контроля, где этот показатель снизился на 2,6% (136,3 против 132,7 у.е.). Показатель pNN50фон достоверно увеличился в основной группе больных на 65,0% (2,0% исходно против 3,3% через 12 нед терапии) в сравнении с группой контроля, где значение этого параметра повысилось на 20,0% (1,5% исходно против 1,8% через 12 нед терапии). Эти и другие изменения показателей ВРС обобщены в таблице 2.
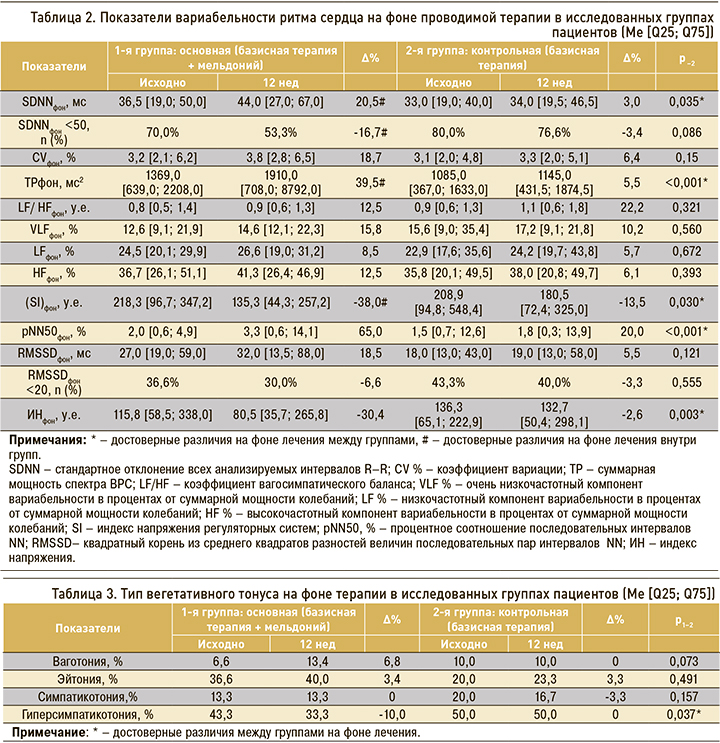
Применение мельдония в составе комбинированной терапии ХСН и ХОБЛ приводит к изменению типов вегетативного тонуса (табл. 3). В основной группе больных было обнаружено достоверное снижение частоты встречаемости гиперсимпатикотонии на 10,0% (43,3% исходно против 33,3% на фоне терапии, тогда как в группе контроля этот показатель не изменился (50,0% до и после терапии)). Разница между группами по конечным результатам была достоверной (р=0,037).
Изменения вегетативной регуляции, отмеченные в ходе исследования, сопровождались улучшением клинического состояния больных с ХСН и ХОБЛ. Так, при анализе показателей ФВД в группе больных с ХСН и ХОБЛ, получавших мельдоний в составе комбинированной терапии, было установлено достоверное увеличение показателей ЖЕЛ на 6,7% (66,5% исходно против 71,0% через 12 нед терапии) и ОФВ1/ФЖЕЛ на 6,1% (65,0% исходно против 69,0% через 12 нед терапии) в сравнении с группой контроля, где первый из указанных параметров увеличился только на 1,4% (68,0% исходно против 69,0% через 12 нед терапии; р >0,05), а второй – лишь на 2,2% (66,5% исходно против 68,0% через 12 нед терапии). В основной группе отмечался прирост МОС75 на 12,5% (32,0% исходно против 36,0% через 12 нед терапии), в то время как в группе контроля увеличения этого показателя не наблюдалось (37,0% до и после терапии). Разница между группами по МОС75 была статистически значимой (р=0,045).
В основной группе больных был выявлен достоверный прирост SpO2 в конце 12 нед терапии после проведения ТШХ (с 93,0 до 94,0%), в группе же контроля существенных изменений этого показателя зарегистрировано не было (с 92,0 до 93,0%).
Кроме того, в основной группе пациентов через 3 мес терапии наблюдалось достоверное снижение ФК ХСН на 20,0% (с 2,5 до 2,0 баллов), чего не наблюдалось в группе контроля, получавшей только базисную терапию ХСН и ХОБЛ, где ФК ХСН не изменился (2,0 балла исходно и после терапии; р1–2=0,009). Количество набранных баллов по шкале ШОКС в основной группе больных также достоверно снизилось на 16,6% (c 6,0 до 5,0 баллов); в группе этот показатель не изменился (6,0 баллов до и после терапии; р >0,05). Разница между группами по шкале ШОКС была статистически значимой (р=0,019). При анализе ТШХ в группе пациентов, получавших в дополнение к базисной терапии ХСН и ХОБЛ мельдоний, было установлено достоверное увеличение проходимой дистанции на 4,9% (с 305,0 м до 320,0 м) в сравнении с пациентами, получавшими исключительно базисную терапию. Разница между группами не достоверна. Через 12 нед терапии у пациентов обеих изучаемых групп было выявлено уменьшение концентрации NT-proBNP: в основной группе уровень этого маркера снизился на 10,5% (с 227,5 до 203,4 фмоль/мл), в группе контроля – на 1,3% (с 219,0 до 216,1 фмоль/мл). В обеих группах указанные значения не достигли критериев значимости.
ОБСУЖДЕНИЕ
В ходе проведенного исследования были отмечены положительные вегетонормализующие эффекты мельдония у пациентов с ХСН и ХОБЛ. На фоне применения этого лекарственного средства в составе комплексной терапии у больных ХСН и ХОБЛ наблюдалось увеличение показателя SDNN и снижение частоты встречаемости SDNN <50 м/с, статистически значимое уменьшение напряженности регуляторных систем в виде снижения ИН и SI в основной группе больных, что может указывать на снижение риска внезапной сердечно-сосудистой смерти у этой категории пациентов [4, 31, 32].
У пациентов, принимавших мельдоний в составе комбинированной терапии ХСН и ХОБЛ, было зарегистрировано достоверное уменьшение частоты встречаемости гиперсимпатикотонии в сравнении с группой контроля, что может служить показателем снижения риска развития сердечно-сосудистых катастроф у коморбидных больных [32].
Обнаруженное вегетонормализующее действие мельдония у больных ХСН и ХОБЛ, вероятно, обусловлено несколькими механизмами его действия.
Причинами развития гиперсимпатикотонии у лиц с ХСН являются хроническое воспаление в стенках сосудистого русла, снижение кровотока во всех органах и тканях, нарастающая гипоксия, обусловливающие активацию нейрогуморальных систем – ренин-ангиотензин-альдостероновой (РААС) и симпатоадреналовой (САС)) [11]. В основе развития вегетативной дисфункции сердца у больных ХОБЛ лежат сходные с ХСН патогенетические механизмы: хронический воспалительный ответ в бронхиальном дереве, нарушения микрогемоциркуляции, изменения эндотелиальной функции, активация РААС и САС, нарастающие гипоксия и гиперкапния. Каскад этих патологических реакций приводит к усугублению течения ХСН и еще большему увеличению активности симпатической нервной регуляции [4, 7]. Мельдоний может эффективно нивелировать эти неблагоприятные патогенетические механизмы. Ранее в наших исследованиях было установлено, что препарат благоприятно действует на эндотелиальную функцию сосудистого русла, микроциркуляцию, активность воспалительного ответа [33, 34]. Кроме того, благоприятное действие мельдония на бронхиальное дерево, миокард и работу вегетативной нервной системы у больных ХСН и ХОБЛ можно объяснить его способностью активизировать выделение оксида азота (NO) эндотелием сосудистого русла и улучшением кровообращения в миокарде [14]. Увеличение выделения NO в кровоток, вероятно, улучшает активность NANC-рецепторов (нехолинергических и неадренергических), чувствительных к уровню NO в крови, что, в свою очередь, ведет к бронходилатации. Улучшение эндотелиальной функции, повышение кровоснабжения бронхиального дерева, снижение воспалительного ответа [14] способствуют нормализации работы М2-ацетилхолиновых рецепторов [35]. Кроме того, Милдронат® обратимо ингибирует превращение гаммабутиробетаина (ГББ) в карнитин. ГББ имеет сходство с ацетилхолиновыми рецепторами [14], что тоже могло благоприятно влиять на работу М2-ацетилхолиновых рецепторов, опосредуя тем самым бронходилатацию [36]. Уменьшение бронхообструкции, по всей видимости, создает условия для увеличения уровня насыщения крови кислородом и снижения гипоксии органов и тканей. В нашем исследовании было обнаружено достоверное увеличение уровня насыщения крови кислородом в крови у пациентов, применявших мельдоний в составе комбинированной терапии на протяжении 12 нед. Повышение SpO2, по-видимому, также может способствовать стабилизации вагосимпатического баланса, симпатической и парасимпатической регуляции: в этом случае снижается активность симпатического звена (увеличение SDNN, снижение частоты встречаемости SDNN <50 м/с, уменьшение ИН и SI), и увеличивается парасимпатическая активность, что подтверждалось достоверным повышением суммарной мощности спектра (ТР) и увеличением показателя pNN50.
Баланс вегетативной нервной системы у больных ХСН и ХОБЛ во многом определяет течение этих заболеваний [4, 8, 31]. Поэтому важным аспектом полученных нами результатов являются данные об улучшении клинического состояния больных ХСН и ХОБЛ, получавших в дополнение к базисной терапии этих заболеваний мельдоний в дозе 1000 мг/сут в течение 12 нед: у них увеличилась дистанция при проведении ТШХ, снизилось количество баллов, набранных по ШОКС, уменьшился ФК ХСН.
ЗАКЛЮЧЕНИЕ
У пациентов, получавших в составе комплексной терапии ХСН и ХОБЛ перорально Милдронат® в дозе 1000 мг/сут в продолжение 12 нед, установлено статистически значимое уменьшение активности симпатического отдела нервной регуляции, снижение напряженности регуляторных систем, достоверное снижение частоты встречаемости гиперсимпатикотонии. Эти эффекты сопровождались достоверным улучшением параметров ФВД, повышением уровня насыщения крови кислородом, снижением ФК ХСН, уменьшением баллов по ШОКС и увеличением дистанции при проведении ТШХ в сравнении с пациентами, находившимися исключительно на терапии базисными препаратами.



