Гиперурикемия – значимый фактор неимунного прогрессирования хронической болезни почек (ХБП) [1, 2], приводящий к формированию нефролитиаза, острой мочекислой блокады, тубулоинтерстициального нефрита [3]. Мочевая кислота прямо активирует ангиотензин II и ренин-ангиотензин-альдостероновую систему (РААС), благодаря которой развивается и поддерживается артериальная гипертензия при ХБП [4, 5]. Показано, что сердечно-сосудистые заболевания выступают непосредственной причиной смерти пациентов с ХБП и гиперурикемией [6, 7].
Несмотря на имеющиеся доказательства роли гиперурикемии в прогрессировании ХБП, механизмы ее прогрессирования остаются малоизученными [3]. Наиболее правдоподобными представляются данные о том, что под действием мочевой кислоты развивается воспаление в разных тканях, в том числе в тубулоинтерстиции почек [8].
Все это свидетельствует о необходимости дальнейшего изучения гиперурикемии для более ясного понимания ее роли в патогенезе ХБП, особенно у пациентов, получающих гемодиализ.
Цель исследования – изучить ассоциацию гиперурикемии с показателями метаболизма у больных с ХБП 5 стадии, получающих гемодиализ.
МАТЕРИАЛ И МЕТОДЫ
Дизайн исследования. Выполнено проспективное исследование «случай–контроль».
Критерии соответствия. Критерии включения: пациенты с ХБП 5 стадии, получающие гемодиализ. Критерии невключения: ХБП 1–4 стадии, отсутствие лечения гемодиализом, хронический перитонеальный диализ, возраст менее 18 и старше 80 лет, патология мышечной ткани, наркомания и алкоголизм, документально подтвержденные психические заболевания, отказ пациента от участия в исследовании.
Условия проведения. Базами для исследования стали кафедра внутренних болезней № 2 Ростовского государственного медицинского университета, диализный центр ООО «Фрезениус Медикал Кеа Кубань» (Ростов-на-Дону), лаборатория медицинского центра ООО «Новомедицина» (Ростов-на-Дону, Россия).
Продолжительность исследования: 01.08.2016 – 01.12.2017.
Описание медицинского вмешательства. Проводился детальный сбор клинико-анамнестических данных, физикальное и лабораторное обследование, включавшее сбор жалоб, анамнеза, проведение объективного осмотра, лабораторное обследование – анализ активности внутриклеточной деградации белка (активность 20S-протеасомы), аутофагии (активность Beclin-1) и апоптоза (активность Bcl-2).
Исследуемые группы: в исследовании приняли участие 102 пациента, соответствовавшие критериям включения, которым осуществлялся гемодиализ на аппаратах 5008 CorDiax (Fresenius Care, Германия) с использованием бикарбонатной буферной диализной жидкости и полисульфоновых высокопоточных диализных мембран FX 50, FX 60, FX 80 или FX 100 с площадью поверхности от 1,5 до 2,3 м2 в следующем режиме: 3 раза в неделю по 4 часа. Средний возраст пациентов составлял 50,9±12,3 лет, средняя продолжительность диализного лечения – 32,8 (17,5–48,5) мес. У 80 из 102 больных определена активность показателей аутофагии, апоптоза и внутриклеточной деградации белка.
Группу 1 составили пациенты с гиперурикемией (n=76), группу 2 – пациенты без нее (n=26). Средний возраст у больных с гиперурикемией был статистически значимо моложе, чем у больных без нее: 49,8±11,6 лет против 56,6±13,3 года (р=0,025) соответственно. Гиперурикемия верифицировалась при уровне мочевой кислоты выше 420 мкмоль/л у мужчин и 350 мкмоль/л у женщин [9]. Синдром недостаточности питания определялся при наличии у пациента одного из следующих признаков: уровень альбумина крови <35 г/л; насыщение трансферрина <20%; содержание лимфоцитов крови <1,8 тыс.; индекс массы тела <18,5 [10, 11]. Активность аутофагии, апоптоза и внутриклеточной деградации белка проводилась на основании определения уровня Beclin-1, Bcl-2 и 20S-протеасомы соответственно. Активность (уровень) показателей определялась методом количественного иммуноферментного анализа на иммуноферментном анализаторе BRIO-ELISA (RADIM, США): Beclin-1 – при помощи набора ELISA Kit for Beclin 1 (Cloud-Clone Corp., США), 20S-протеасомы – набора ELISA Kit for 20S-Proteasome (Cloud-Clone Corp., США), Bcl-2 – набора ELISA Kit for B-Cell Leukemia/ Lymphoma 2 (Cloud-Clone Corp., США). Биоимпедансный анализ выполнен при помощи биоимпедансного анализатора Вody Composition Monitor (ВСМ) – монитор состава тела с программным обеспечением Fluid Management Tool (FMT) фирмы Fresenius (Германия, регистрационное удостоверение № ФСЗ 2009/03662 от 05.02.2009). Индекс массы тела (ИМТ) рассчитан по стандартной формуле: масса (кг)/рост (см)2 [12]. Дефицит висцерального пула белка определялся при уровне сывороточного альбумина <35 г/л, соматического – по стандартной формуле: ОМП (см) = ОП (см) – 0,314 × КЖСТ (мм), где ОМП — окружность мышц плеча, ОП – измеренная окружность плеча, КЖСТ – толщина кожно-жировой складки над трицепсом. За дефицит принимался расчетный показатель ОМП менее 22 см у женщин и менее 24 см у мужчин [13].
Этическая экспертиза. Протокол исследования одобрен локальным независимым этическим комитетом ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России (протокол № 13/18 от 13.09.2018).
Статистический анализ. Использовались пакеты прикладных программ Excel-2016 (Microsoft Corp., США), Statistica-12 (StatSoft, США). Размер выборки предварительно не рассчитывался. Представление количественных показателей при их нормальном распределении выполнено в виде M±SD, при распределении, отличном от нормального – Me (нижний квартиль (LQ) – верхний квартиль (HQ)). Характер распределения (нормальное или отличное от нормального) оценивался при помощи одновременного вычисления для каждого показателя критериев Колмогорова–Смирнова, Шапиро–Уилка и Лиллефорса. Распределение считалось отличным от нормального, если два и более критериев отвергали нулевую гипотезу. Выявление статистической значимости различий количественных переменных выполнялось для двух выборок путем вычисления t-критерия Стьюдента при нормальном распределении или критерия Манна–Уитни для показателей, распределение которых отличалось от нормального. Выявление статистической значимости различий для качественных/порядковых переменных выполнено при помощи критерия c² для таблиц сопряженности вида 2 × 2 или точного критерия Фишера, если количество наблюдений в одной из ячеек четырехпольной таблицы было <5. Внутригрупповые различия средних значений показателей вычислены при помощи парного критерия Вилкоксона. Различия считались статистически значимыми при p <0,05.
РЕЗУЛЬТАТЫ
Наличие синдрома недостаточности питания не влияло на частоту гиперурикемии, которая отмечалась у 71% (66 из 93) в группе больных с синдромом недостаточности питания и 76,9% (10 из 13) в группе пациентов без недостаточности питания (р=0,468).
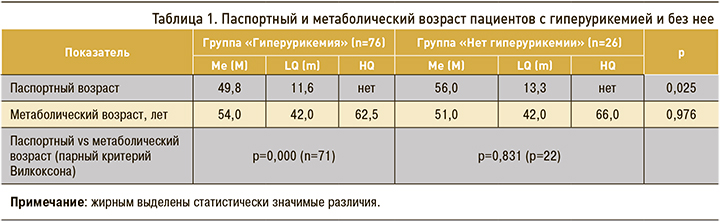
Больные с гиперурикемией были статистически значимо моложе по сравнению с группой без гиперурикемии, в то время как метаболический возраст пациентов при гиперурикемии существенно превышал паспортный (табл. 1).
Частота постинфарктного кардиосклероза и хронической сердечной недостаточности более II степени и 3 функционального класса в группе гиперурикемии была статистически значимо ниже по сравнению с группой без гиперурикемии: 9,2 (7) в сравнении с 26,9% (7; р=0,024) и 19,7 (15) по сравнению с 42,3% (11; р=0,023) соответственно.
На уровень мочевой кислоты проводимый гемодиализ влияния практически не оказывал. При этом показатели эффективности диализа (Kt/V), его доза и коэффициент снижения (очищения) мочевины в группе гиперурикемии были статистически значимо выше (табл. 2).

Доля неадекватного диализа по показателю Kt/V у больных с гиперурикемией была статистически значимо ниже: 2,7 (2 из 75) по сравнению с 15,4% (4 из 25) (р=0,037), там же диализ чаще был оптимальным: 49,3 (37) по сравнению с 26,9% (7; р=0,047). У порядка половины больных в обеих группах диализ характеризовался как адекватный: 48,0% (36) среди пациентов с гиперурикемией и 57,7% (15) – без гиперурикемии (р=0,364). Не выявлено корреляционной зависимости между показателем Kt/V и уровнем мочевой кислоты (R=-0,136; p >0,05).
Композиционный состав тела больных с гиперурикемией характеризовался избытком массы тела. ИМТ при гиперурикемии составил 28,3 (24,3–31,4) по сравнению с 25,1 (22,3–28,1; р=0,021) при ее отсутствии. Масса тела была избыточной у ≥50% больных в обеих группах. При этом доля пациентов с ИМТ выше верхнего референсного предела была достоверно выше в группе гиперурикемии: 75,0 (57 из 76) против 50% (13; р=0,018) в группе без гиперурикемии. ИМТ в пределах референсного интервала статистически значимо чаще регистрировался среди пациентов без гиперурикемии: 50,0 (13) против 23,7% (18; р=0,012).
Абсолютный показатель жировой массы в группе гиперурикемии составил 20,3±10,9 против 13,5±8,5 кг в группе пациентов без гиперурикемии (р=0,005), относительный показатель жировой массы 24,8±10,1 и 17,4 ± 9,7% (р=0,002) соответственно. Доля пациентов с абсолютным показателем жировой массы выше верхнего референсного предела в группе гиперурикемии была статистически значимо выше и составила 64,5 (49) против 42,3% у больных без гиперурикемии (11; р=0,047). В группе гиперурикемии была больше доля пациентов с высоким вкладом жировой массы в композиционный состав тела: 40,8 (31) против 15,4% (4; р=0,015).
Относительный показатель активной клеточной массы в группе гиперурикемии был ожидаемо ниже по сравнению с группой без гиперурикемии: 37,3 (31,4–40,5%) против 52,0% (50,0–54,0%) (р=0,007). У больных с гиперурикемией показатель активной клеточной массы (%) ниже нижнего референсного предела отмечался чаще, чем в отсутствие гиперурикемии: 60,5 (46) по сравнению с 23,1% (6; р=0,001). Соответственно число пациентов с нормальным уровнем активной клеточной массы (%) была больше в группе без гиперурикемии: 65,4 (17) против 26,3% (20; р=0,000). Существенных межгрупповых различий по абсолютным показателям безжировой и активной клеточной массы выявлено не было. Также не были обнаружены различия по частоте встречаемости показателей различного уровня сухого веса, активной клеточной массы (кг) и безжировой массы.
Общий объем жидкости у большинства больных с ХБП 5 стадии как с гиперурикемией, так и без нее находился в пределах референсного интервала: 69,7% (53) в первом случае, 65,4% (17; р=0,680) – во втором. В то же время у 14,5% (11) пациентов группы гиперурикемии количество внеклеточной жидкости было ниже нижнего референсного предела; в группе без гиперурикемии таких больных зарегистрировано не было (р=0,032).
Показатель внеклеточной жидкости в пределах референсного интервала имел место у большинства больных с ХБП 5 стадии: 73,7 (56) и 84,6% (22; р=0,195) у больных с гиперурикемией и без нее. В то же время у большинства больных обеих групп количество внутриклеточной жидкости было ниже нижнего референсного предела: в группе гиперурикемии у 64,5% (49), без нее у 57,7% (15; р=0,537). Полученные данные свидетельствуют о том, что купирование гипергидратации у большинства больных с ХБП 5 стадии посредством гемодиализа сопровождается внутриклеточной дегидратацией.
Не выявлено достоверных межгрупповых различий средних величин показателей протеасомной деградации белка (20S-протеасома), аутофагии (Beclin-1) и апоптоза (Bcl-2).
Корреляционный анализ выявил слабую положительную корреляционную зависимость между показателями общего объема жидкости, объема внеклеточной жидкости и Beclin-1: R=0,269; р <0,05 и R=0,268; p <0,05 соответственно. Такой же силы обратная зависимость была обнаружена между общим объемом жидкости, объемом внеклеточной жидкости и активностью 20S-протеасомы (R= 0,279; p <0,05) и (R=-0,280; p <0,05). То есть увеличение внеклеточной жидкости у больных ХБП 5 стадии на гемодиализе ассоциировано с активацией аутофагии и снижением активности внутриклеточной деградации белка. Гиперурикемия не оказывает существенного влияния на указанные процессы.
Нами не выявлено статистически значимых межгрупповых различий в показателях систолического, диастолического артериального давления и частоты сердечных сокращений у пациентов с гиперурикемией и без нее. При этом средний уровень систолического артериального давления в обеих группах был выше верхней референсной границы: 144,0 (132,5–154,0) и 146,0 (131,0–153,0) мм рт.ст. (р=0,639).
Не было обнаружено статистически значимых межгрупповых различий в частоте встречаемости соматического и висцерального пула белка. При этом недостаточность соматического пула белка отмечалась чаще, чем висцерального.
Не установлена корреляционная зависимость между уровнем альбумина и показателями аутофагии, апоптоза и протеасомной деградации белка. Отсутствовала дифференциация показателей мышечной функциональности в группах гиперурикемии и без нее.
Отсутствовали межгрупповые различия показателей фосфорно-кальциевого обмена (уровень интактного паратгормона, фосфора и общего кальция) в группах гиперурикемии и без нее.
Выявлено, что уровень фермента гамма-глутамин транспептидазы (ГГТП) в сыворотке крови пациентов с гиперурикемией был статистически значимо ниже по сравнению с пациентами без гиперурикемии: 82,2±149,2 vs 37,0±38,5 ЕД/л (р=0,020). Уровень С-реактивного белка в обеих группах статистически значимо не различался и соответствовал референсным пределам.
Показатель бета-2-микроглобулина в обеих группах на порядок превышал референсный интервал: 26,1±6,9 и 25,9±6,1 мг/л (р=0,924).
Анализ межгрупповых различий клеточного состава крови больных с гиперурикемией и без нее (лейкоциты, тромбоциты, лимфоциты) не смог опровергнуть нулевую гипотезу.
В ходе настоящего исследования выявлено, что частота применения агонистов имидазолиновых рецепторов I у больных с гиперурикемией была выше по сравнению с пациентами без гиперурикемии: 35,5 (27) против 11,5% (3; р=0,016). Межгрупповых различий по частоте назначения других препаратов не выявлено.
ОБСУЖДЕНИЕ
Нами установлено, что при гиперурикемии метаболический возраст пациентов существенно увеличивается. Более быстрое метаболическое старение может быть обусловлено снижением на фоне гиперурикемии антиоксидантной защиты клеток, которое приводит к разрушению фосфолипидного слоя мембран клеток и их гибели. Согласно литературным данным, действие мочевой кислоты зависит от ее уровня в плазме крови: при низком уровне она служит антиоксидантом, при высоком – прооксидантом. Антиоксидантное действие растворимых форм мочевой кислоты заключается в нейтрализации свободных радикалов и свободного оксида азота при соединении с ними. Также мочевая кислота ингибирует деградацию антиоксидантных ферментов эндотелия сосудов супероксиддисмутазы и каталазы [14]. Гиперурикемия выступает активатором пролиферации и воспаления. Мочевая кислота посредством специфических органических транспортеров проникает внутрь клеток гладкой мускулатуры кровеносных сосудов, активирует внутриклеточные протеинкиназы (p38 и Erk 1/2) и ядерные факторы транскрипции (каппа-В – NF-kappa-B, активаторный белок-1 – АР-1), в результате чего формируется пролиферативный и провоспалительный фенотип. Гладкомышечные клетки сосудов начинают продуцировать факторы роста (фактор роста тромбоцитов), вазоконстрикторные вещества (ангиотензин II (А2) и тромбоксан (TXA2)), провоспалительные молекулы (С-реактивный белок, моноцитарный хемоаттрактантный белок-1 – МСР-1) [15, 16].
Одновременно под действием мочевой кислоты в эндотелиальных клетках и клетках гладкой мускулатуры происходит экспрессия рецепторов к ангиотензину II типа 1 [17]. Гиперурикемия вызывает повышение продукции интерлейкина 1-бета, интерлейкина-6, тумор-некротического фактора альфа, которые являются ведущими компонентами провоспалительного механизма [18]. В то же время полученные нами данные свидетельствуют о том, что гемодиализная терапия существенно снижает провоспалительную активность высокого уровня мочевой кислоты.
Выявлено отсутствие статистически значимых межгрупповых различий уровня С-реактивного белка у больных с ХБП 5 стадии, находящихся на гемодиализе с гиперурикемией и с отсутствием таковой. Несмотря на то что пациенты в нашем исследовании с гиперурикемией требовали статистически значимо большей дозы диализа, на этом фоне отмечены достоверно более высокие коэффициенты снижения мочевины, эффективности диализа (Kt/V) и частоты оптимального диализа по сравнению с группой пациента без гиперурикемии.
Прооксидантный эффект высокого уровня мочевой кислоты и ее влияние на механизмы старения у пациентов с ХБП 5 стадии, находящихся на гемодиализе, подтверждают и полученные нами данные.
Нами установлено, что в группе больных с гиперурикемией частота постинфарктного кардиосклероза и хронической сердечной недостаточности более II степени и 3 функционального класса была значимо ниже по сравнению с группой пациентов без гиперурикемии. Данные же литературы свидетельствуют, что кардиальная патология служит ведущей причиной летальности при ХБП [19, 20]. В связи с этим интерес представляют противоречивые результаты исследований именно пациентов с ХБП, находящихся на гемодиализе, относительно зависимости риска сердечно-сосудистой смерти от уровня мочевой кислоты. Исследование 5827 гемодиализных больных, выполненное в 6 странах мира, показало, что содержание мочевой кислоты ассоциировано с низким уровнем общей и сердечно-сосудистой летальности: HR=0,95; 95% CI=0,90–1,00 на каждый уровень повышения мочевой кислоты на 1 мг/дл и HR=0,92; 95% CI=0,86–0,99 соответственно. Риск летального исхода при низком уровне мочевой кислоты ≤8,2 мг/дл по сравнению с уровнем >8,2 мг/ дл составил для общей летальности 1,24; 95% CI=1,03–1,49 и для сердечно-сосудистой летальности – 1,54; 95% CI=1,15–2,07. По мнению авторов, полученные результаты могут свидетельствовать о кардиопротективном эффекте мочевой кислоты на фоне проводимого гемодиализа, однако механизм такого действия остается неясным [21]. Существует мнение, что низкий уровень мочевой кислоты является маркером низкой белковой нагрузки и свидетельствует о наличии синдрома недостаточности питания [19]. В то же время полученные нами данные выявили высокую частоту встречаемости гиперурикемии как у пациентов с синдромом недостаточности питания, так и при его отсутствии: 71 (66 из 93) и 76,9% (10 из 13; р=0,468) соответственно.
В ходе настоящего исследования выявлен более низкий уровень ГГТП в сыворотке крови пациентов с гиперурикемией по сравнению с пациентами без нее. Повышение содержания ГГТП в крови служит маркером нарушения функции печени, однако отсутствие среди исследованных больных повышения уровня трансаминаз свидетельствует о том, что печеночная функция у пациентов с ХПН 5 стадии сохранена, а высокий уровень мочевой кислоты оказывает тормозное воздействие на уровень ГГТП.
ЗАКЛЮЧЕНИЕ
- Пациенты с ХБП 5 стадии и гиперурикемией, находящиеся на гемодиализе, характеризуются преждевременным метаболическим старением.
- У больных с ХБП 5 стадии и гиперурикемией отмечается сниженная частота коморбидной кардиальной патологии, ассоциированная с высоким риском летального исхода – постинфарктного кардиосклероза и хронической сердечной недостаточности более II степени и более 3 функционального класса.
- Эффективность гемодиализа среди пациентов с гиперурикемией была выше, несмотря на то что гемодиализ практически не влиял на уровень мочевой кислоты.
- Для пациентов с ХБП 5 стадии на гемодиализе была характерна нормогидратация, сопровождающаяся внутриклеточной дегидратацией. При этом увеличение внеклеточной жидкости ассоциировано с активацией аутофагии и снижением активности внутриклеточной деградации белка.
- Процедура программного гемодиализа существенно снижает провоспалительную активность гиперурикемии, о чем свидетельствует показатель С-реактивного белка в пределах референсных значений как в группе с гиперурикемией, так и без таковой.


