Значительная распространенность аллергических заболеваний в XXI в. сопровождается высокими показателями заболеваемости бронхиальной астмой (БА) – одной из самых распространенных хронических болезней бронхолегочной системы, которую характеризует гетерогенность с различной степенью проявления бронхиальной обструкции [1, 2].
Частота БА, по данным официальной статистики, составляет 5–10% среди детского населения. Несмотря на многочисленные успешные исследования, активное внедрение в практику диагностических и терапевтических программ, своевременное установление диагноза БА в детском возрасте остается сложной задачей [2, 4]. В настоящее время активно обсуждаются вопросы полиэтиологичности, особенностей клинического течения БА в зависимости от возраста ребенка, нарушений на генном уровне, определяющих реакцию на воздействие неблагоприятных факторов как респираторной, так и нейроэндокринно-иммунной систем, что лежит в основе формирования тяжести болезни, особенностей ее клинического течения и предполагает персонифицированный подход к диагностике и лечению [2 ,3, 4].
Основой успешного диагностического и терапевтического процесса служат:
- установление лидирующего механизма в возникновении обострения БА, имеющего решающее значение в формировании астматических атак;
- определение для каждого подтипа уникальных и общих механизмов с помощью специфичных биомаркеров, позволяющее проводить персонифицированную эффективную направленную терапию [5–8].
ЗНАЧЕНИЕ ИЗУЧЕНИЯ ГЕТЕРОГЕННОСТИ АСТМЫ
Гетерогенность БА проявляется не только разной степенью бронхиальной обструкции, но и разным ответом на действие бронходилататоров, глюкокортикоидов. Тщательный анализ факторов, способствующих прогрессированию заболевания, развитию осложнений, позволит проводить строго направленную терапию БА с учетом феноэндотипов этой патологии [7, 8].
Определение феноэндотипа БА представляет собой унифицированный и последовательный подход к развитию болезни в сочетании с клиническими и физиологическими характеристиками, лежащими в основе патобиологии с идентифицируемыми биомаркерами, генетикой и ответом на общую и специфическую терапию. Фенотип описывает клинические варианты и не дает представления о патофизиологических механизмах. Эндотипы БА – это интеграция определенной идентифицируемой основы патобиологического процесса с формированием клинических симптомов. У одного пациента может наблюдаться несколько феноэндотипов БА с возможной их трансформацией. Проведение направленной терапии с учетом имеющегося феноэндотипа БА позволяет достичь наиболее значимого эффекта [7, 8, 9].
Профессор Wenzel S. – один из крупнейших специалистов по гетерогенности астмы – предложила на основании молекулярного эндотипирования в рамках эндотипов Тh2- и Th1-воспаления выделять соответствующие фенотипы заболевания [7, 8]:
- Тh2-астма объединяет различные варианты БА и эозинофильного воспаления. При этой атопической форме БА имеет место в основном благоприятное течение заболевания и хороший ответ на глюкокортикостероиды (ГКС) [5];
- неTh2-астма характеризуется поздним дебютом, ожирением, связью с курением, нейтрофильной астмой у некурящих. Она связана больше с нейтрофильным воспалением в дыхательных путях и постоянной бактериальной колонизацией (или опосредованным воздействием инфекции дыхательных путей) [8, 9]. Этот феноэндотип БА имеет тяжелое течение с выраженной деструкцией легочной ткани, низким ответом на ГКС-терапию. В эту же группу относят астму с малогранулоцитарным воспалением.
При ДСТ имеет место нарушение формирования эластического каркаса легких, что обусловливает изменение архитектоники легочной ткани в виде деструкции межальвеолярных перегородок и недоразвития эластических и мышечных волокон в мелких бронхах и бронхиолах, ведущих к повышенной растяжимости и снижению эластичности легочной ткани. Такие изменения формируют клапанный механизм бронхиальной обструкции и образование эмфизематозных булл, поликистоза, последствием которых при субплевральной локализации булл может быть спонтанный пневмоторакс [10, 11].
Врожденный дефект хрящевого и соединительнотканного каркаса трахеи и бронхов приводит к повышенной их подвижности, дискинезии, возникновению бронхоэктазов [10–13].
Трахеобронхиальная дискинезия формируется при морфологических изменениях в стенке бронхов, а также при вегетативных расстройствах. В результате нарушается дренажная функция бронхов, снижается активность механизмов местной защиты с развитием инфекционно-воспалительного процесса бронхолегочной системы [11, 14]. Дискинезия трахеи и бронхов способствует развитию бронхиальной обструкции.
В последние 10–15 лет отмечается возрастание числа атипичных пневмоний, вызванных внутриклеточными возбудителями и протекающих у детей с ДСТ с вовлечением не только альвеолярной, но и интерстициальной ткани легкого. Клинические проявления таких пневмоний зачастую малосимптомны [15]. Наличие бронхиальной обструкции на фоне пневмоний приводит к ошибочно диагностируемым ОРВИ. В результате этиопатогенетическая терапия не назначается, возникают тяжелые осложнения (пневмофиброз, бронхоэктазы, воздушные буллы) [11, 14].
У пациентов с БА и проявлениями ДСТ формирование осложнений происходит быстро [11, 14].
Широкая распространенность ДСТ, представленная различными фенотипами с разным уровнем нарушений соединительной ткани, вовлечением нескольких органов и систем в патологический процесс, вызывает необходимость изучения связи фенотипов БА у детей с разными фенотипами ДСТ.
Цель исследования – изучить клинические особенности фенотипов БА у детей с различными фенотипами ДСТ.
МАТЕРИАЛ И МЕТОДЫ
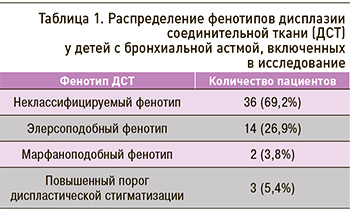 Обследовано 55 детей с БА в возрасте 3–18 лет, имеющих проявления ДСТ. Фенотипы ДСТ (табл. 1) определялись с использованием рекомендуемых диагностических критериев [12, 13].
Обследовано 55 детей с БА в возрасте 3–18 лет, имеющих проявления ДСТ. Фенотипы ДСТ (табл. 1) определялись с использованием рекомендуемых диагностических критериев [12, 13].
Диагноз БА был установлен согласно современным диагностическим протоколам [1, 2]. Для его уточнения было проведено необходимое лабораторное (гемограмма, урограмма, бак. посев мокроты на микробиоту и чувствительность к антибиотикам, иммуноферментный анализ с определением титра антител к внутриклеточным возбудителям, герпес-вирусам, полимеразно-цепная реакция), инструментальное обследование (рентгенография органов грудной клетки, компьютерная томография, электрокардиография, эхокардиография).
Статистическая обработка полученных данных выполнялась с вычислением показателя соответствия (c2).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При обследовании легкое персистирующее течение (II степень тяжести) БА встречалось у 41 (74,5%) пациента, среднетяжелое персистирующее (III степень тяжести) – в 2,9 раз реже (14 больных, 25,5%).
Анализ зависимости степени тяжести БА с разными фенотипами ДСТ показал, что III степень заболевания имела место достоверно чаще (р <0,001) у детей с более выраженными нарушениями соединительнотканного каркаса – марфаноподобным фенотипом (МПФ, 100%) и элерсоподобным фенотипом (ЭПФ, 78,6%) в сравнении с пациентами с неклассифицируемым фенотипом (НКФ, 2,8%).
II степень тяжести БА достоверно чаще (р <0,001) выявлялась у детей с повышенным порогом диспластической стигматизацией (пДС, 100%) и НКФ (97,2%) в сравнении с больными с ЭПФ (21,4%).
У 27 (49,0%) больных БА была установлена внебольничная пневмония (ВП). В зависимости от фенотипа ДСТ пневмония отмечалась у всех детей с МПФ (100%), у 12 (85,7%) с ЭПФ, у 13 (36,1%) с НКФ, что, безусловно, усугубляло тяжесть клинических симптомов при обострении БА.
Этиология ВП была в большинстве случаев (в 95,7%) представлена микоплазменной инфекцией, в 65,2% – герпес-вирусной инфекцией (цитомегаловирус – 47,8%, вирус Эпштейна–Барр – 17,4%), в 17,4% – хламидийной инфекцией, в 8,7% – пневмококком. Более чем у половины обследованных детей (69,6%) выявлено сочетание инфекционных факторов.
У больных БА длительность бронхообструкции составила 4,2±1,8 сут, при сочетании БА и ВП – 9,2±2,0 сут с симптомами интоксикации, физикальными изменениями в легких, характерными для пневмонии. Более тяжелое и длительное течение бронхообструктивного эпизода, отсутствие терапевтического эффекта от ингаляционных глюкокортикоидов (ИГКС) потребовало расширения базисной терапии пациентам с БА и ВП, назначения антибактериальных препаратов.
Персистирующее течение БА у 18 (32,7%) детей с ДСТ и ВП способствовало формированию легочной гипертензии: она была выявлена у всех (100%) пациентов с МПФ, у 12 (85,7%) – с ЭПФ, у 4 (11,1%) – с НКФ. У больных с пДС формирования легочной гипертензии отмечено не было.
У 12 (21,8%) детей с БА, ВП, ДСТ выявлены симптомы формирования пневмофиброза (ПФ):
- у всех пациентов с БА, ВП и МПФ (100%), имевших признаки формирования легочной гипертензии;
- у 9 (64,3%) детей с БА, ВП, ЭПФ на фоне формирования легочной гипертензии;
- у 1 пациента (2,8%) с БА, ВП, НКФ и симптомами формирования легочной гипертензии, что достоверно реже (р <0,001) в сравнении с больными с МПФ и ЭПФ.
Исследование особенностей клинических проявлений БА позволило разделить всех пациентов на 3 группы (табл. 2).
Соотношение фенотипов ДСТ в указанных группах отражено в таблице 3.
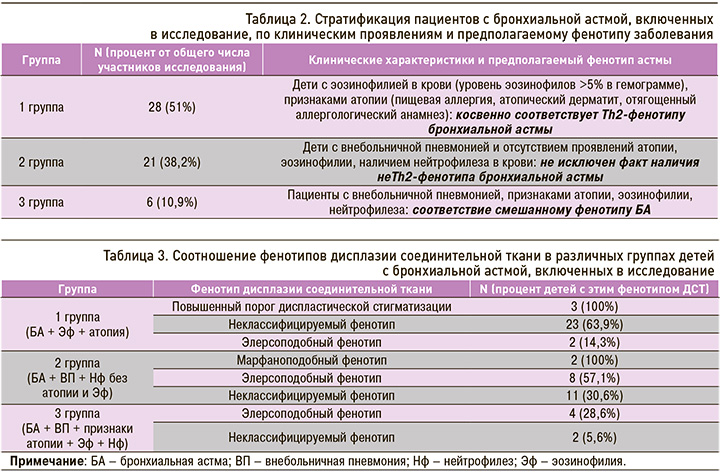
Таким образом, атопическая форма БА имела место у детей с ДСТ с менее значимыми изменениями соединительной ткани (пДС, НКФ). У больных с БА и ДСТ, протекающей с выраженными нарушениями со стороны соединительной ткани (МПФ, ЭПФ), отмечено более тяжелое течение БА, связанное с возникновением ВП при отсутствии проявлений атопии, неэффективностью ИГКС и необходимостью включения в протокол лечения антибактериальной терапии.
Статистическая обработка полученных данных позволила установить неслучайность отсутствия у детей с БА, имеющих МПФ и ЭПФ, признаков атопии, Эф; возникновение ВП (c2 =-0,9; р <0,001), что ассоциируется с проявлением не Тh2-фенотипа БА. В связи с этим при затяжном течении эпизодов бронхиальной обструкции у больных с БА, МПФ и ЭПФ необходимо исключить не Тh2-фенотип БА, имеющий низкую чувствительность к стероидной терапии, и проводить адекватную терапию БА, включающую антибактериальные препараты.
ЗАКЛЮЧЕНИЕ
1. Установлена тесная связь между БА у детей и проявлениями ДСТ.
2. Среднетяжелое течение БА достоверно чаще отмечено при МПФ и ЭПФ, легкое персистирующее течение – при пДС и НКФ.
3. ВП, усугубляющая клиническое течение БА с удлинением эпизода бронхообструкции (более чем в 2,5 раза), чаще имела место у пациентов с МПФ и ЭПФ в сравнении с пациентами с НКФ.
4. У 2/3 больных с БА установлена полиэтиологичность ВП (микоплазмы, герпес-вирусы, хламидии, пневмококки).
5. При персистирующем течении БА с ВП у 32,7% пациентов с МПФ и ЭПФ выявлена легочная гипертензия. У 21,8% больных с БА, ВП, легочной гипертензией и МПФ/ ЭПФ отмечено формирование пневмофиброза.
6. Пациенты с БА и фенотипами ДСТ с более значительными изменениями со стороны соединительной ткани (МПФ, ЭПФ) при отсутствии атопических проявлений имели более тяжелое течение БА (возникновение ВП, формирование осложнений – легочной гипертензии, пневмофиброза) и низкую чувствительность к ИГКС, что вызвало необходимость включения антибиотиков в протокол лечения.
7. Признаки МПФ, ЭПФ можно использовать в диагностике неТh2-фенотипа БА у детей, прогнозируя низкий эффект стероидной терапии.


