ВВЕДЕНИЕ
В Республике Саха (Якутия) на протяжении последних 10 лет заболеваемость туберкулезом и смертность от него имеют тенденцию к снижению. В 2020 г. заболеваемость туберкулезом уменьшилась на 17,1% по сравнению с 2019 г. и составила 29,7 случаев на 100 000 населения. Смертность достигла исторического минимума – 2,4 случая на 100 000 населения. При этом индикаторы эффективности лечения в 2020 г. были ниже мировых. Терапия впервые выявленного туберкулеза оценивалась как эффективная у 79,3% пациентов.
Изониазид остается эффективным химиотерапевтическим средством первой линии для лечения лекарственно-чувствительного туберкулеза. Он нарушает синтез миколовых кислот, оказывая селективное бактериостатическое действие на неделящиеся микобактерии туберкулеза и бактерицидное влияние на микроорганизмы в стадии размножения. К сожалению, применение изониазида сопряжено с развитием таких нежелательных побочных реакций, как нейротоксичность, гепатотоксичность, угнетение кроветворения [1]. Гепатотоксические реакции становятся ведущей причиной отмены препарата, что значительно уменьшает эффективность противотуберкулезной терапии, повышает риск рецидива заболевания и способствует формированию вторичной лекарственной устойчивости микобактерий туберкулеза [2, 3].
Частота развития побочных эффектов изониазида зависит от генетических и негенетических факторов. Вариабельность фармакологического ответа в значительной степени обусловлена полиморфизмом гена фермента ацетилирования изониазида – N-ацетилтрансферазы 2 (NAT2). Полиморфизм гена NAT2 определяет индивидуальные различия фармакокинетики изониазида и идентифицирован как фактор риска гепатотоксичности этого лекарственного средства [1, 4–6].
В популяции в зависимости от генетически детерминированной активности NAT2 выделяют людей с быстрым, промежуточным и медленным фенотипами ацетилирования. У медленных ацетиляторов после приема изониазида в стандартных дозах его концентрация в плазме в 4–6 раз выше, чем в плазме быстрых ацетиляторов [3, 7, 8]. Установлены положительные корреляционные связи между медленным фенотипом ацетилирования изониазида и высокой частотой развития гепатотоксических реакций. Низкая концентрация изониазида в плазме быстрых ацетиляторов ассоциируется с неудачей лечения туберкулеза и ростом лекарственной устойчивости микобактерий [9].
Цель настоящего исследования – изучить влияние скорости ацетилирования при участии NAT2 на фармакокинетику изониазида и риск развития гепатотоксических реакций при лечении этим средством туберкулеза легких у больных, проживающих в Республике Саха (Якутия).
В соответствии с целью исследования были поставлены и решены следующие задачи.
1. Методом полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) провести генотипирование 6 однонуклеотидных замен гена NAT2: NAT2*5 (341T>C), NAT2*6 (590G>A), NAT2*7 (857G>A), NAT2*11 (481C>T), NAT2*12 (803A>G) и NAT2*13 (282C>T) – у больных туберкулезом легких и сформировать группы в зависимости от скорости ацетилирования изониазида (быстрые, медленные и промежуточные ацетиляторы).
2. Установить взаимосвязь между скоростью ацетилирования и частотой гепатотоксических реакций при химиотерапии изониазидом пациентов с туберкулезом легких.
3. Определить фармакокинетические параметры изониазида, изучить влияние типов ацетилирования на фармакокинетику этого лекарственного средства при туберкулезе.
МАТЕРИАЛ И МЕТОДЫ
В проспективном сравнительном одноцентровом когортном фармакогенетическом и фармакокинетическом исследовании приняли участие 146 пациентов с впервые выявленным туберкулезом легких, госпитализированных в 2019–2021 гг. в терапевтическое отделение ГБУ Республики Саха (Якутия) «Научно-практический центр “Фтизиатрия” им. Е.Н. Андреева» (Якутск).
Среди пациентов было 59 (40,4%) женщин и 87 (59,6%) мужчин. Масса тела больных равнялась 60,6±12,8 кг, средний возраст – 39,3±14,1 лет. Якуты составляли 78,8% (115) пациентов, русские – 21,2% (31).
Критерии включения в исследование: впервые в жизни выявленный туберкулез легких, интенсивная фаза противотуберкулезной химиотерапии с обязательным включением изониазида, возраст 18–60 лет, подписанное больным информированное согласие.
Критерии исключения: генерализованный туберкулез, ВИЧ-инфекция, наличие злокачественных новообразований, беременность, прием любого лекарственного средства длительностью более недели на протяжении последнего месяца, продолжительность интенсивной фазы химиотерапии менее 60 дней, употребление алкогольных напитков.
Все пациенты для лечения туберкулеза получали изониазид в дозе 5–10 мг/кг/сут (не более 600 мг/ сут), этамбутол 15–25 мг/кг/сут (не более 2000 мг/сут), рифампицин 10 мг/кг/сут (не более 600 мг/сут), пиразинамид 25–30 мг/кг/сут (не более 2500 мг/сут).
Для генетического исследования осуществляли забор 3–4 мл крови из вены локтевого сгиба в вакуумные пробирки с помощью закрытой вакуумной системы (Zhejiang Gongdong Medical Technology Co., Ltd, Китай). Пробирки имели мелкодисперсное напыление К3 этилендиаминтетрауксусной кислотой. Для генотипирования из цельной крови выделяли ДНК с помощью набора реагентов ExtractDNA Blood (ЗАО «Евроген», Россия). Носительство полиморфных вариантов NAT2*5 (rs1801280), NAT2*6 (rs1799930), NAT2*7 (rs1799931), NAT2*11 (rs1799929), NAT2*12 (rs1208), NAT2*13 (rs1041983) выявляли методом ПЦР-РВ на амплификаторе Real-Time CFX96 Touch (Bio-Rad, США) с использованием набора реагентов «ГенТест-М NAT2» (ООО «НОМОТЕК», Россия).
Скорость ацетилирования определяли по экспрессии гена NAT2. У быстрых ацетиляторов в гене присутствовали 2 быстрых аллели, у промежуточных — 1 быстрая и 1 медленная аллель, у медленных — 2 медленных аллели [10].
Переносимость лечения оценивали ежедневно по клиническим симптомам и 1 раз в месяц или чаще по данным общего и биохимического анализа крови. Гепатотоксичность изониазида характеризовали на основании результатов клинико-лабораторного мониторинга с использованием критериев, разработанных экспертами Европейской ассоциации по изучению печени (EASL) и опубликованных в клинических рекомендациях EASL 2019 г. В ходе исследования регистрировались: а) рост в сыворотке крови активности аланинаминотрансферазы (АЛТ) в 5 и более раз выше верхней границы нормы (ВГН) независимо от наличия симптомов патологии печени и уровня билирубина; б) повышение в сыворотке крови активности щелочной фосфатазы (ЩФ) в 2 и более раз выше ВГН, особенно в сочетании с увеличением активности гамма-глутамилтранспептидазы; в) повышение в сыворотке крови активности АЛТ в 3 и более раз выше ВГН при наличии симптомов гепатита (анорексии, тошноты, слабости, желтухи, боли в правом подреберье) и/или в сочетании с ростом содержания общего билирубина в 2 и более раз выше ВГН [11]. Если у пациентов до начала лечения были повышены активность ферментов и содержание билирубина, за норму принимали их средние значения. Случаи нелекарственных поражений печени из исследования исключали.
Активность АЛТ, ЩФ, гамма-глутамилтранспептидазы и содержание общего билирубина в сыворотке крови определялись на автоматическом биохимическом анализаторе XL-640 (Erba Lachema, Чехия) с помощью реагентов XL System Pack® (ERBA Mannheim, Чехия). У всех пациентов утром натощак из локтевой вены забирали 8–9 мл крови в вакуумные пробирки без наполнителя (Zhejiang Gongdong Medical Technology Co., Ltd, Китай).
Для фармакокинетического исследования 35 пациентам в течение трех дней 1 раз/сут вливали в вену капельно изониазид в дозе 10 мг/кг (не более 600 мг/ сут). Пробы крови получали на 4-й день: за 15 мин до инъекции изониазида, затем через 30 мин, 1, 2, 3, 4, 5, 6, 8, 10, 12, 16 и 24 ч после нее. Кровь центрифугировали при 3000 g в течение 10 мин, плазму подвергали «шоковой заморозке» жидким азотом. Концентрацию изониазида в сыворотке крови определяли в градиентном режиме на микроколоночном жидкостном хроматографе «Милихром А-02» с колонкой ProntoSIL-120-5-C18 AQ («ЭкоНова», Новосибирск) при соблюдении следующих условий: элюент А — октилсульфонат 0,4%, трифторуксусная кислота 0,1%, рН 2,2; элюент Б — ацетонитрил; длина волны — 266 нм; температура — 400 °С; давление — 2,5–5,5 Мпа; объем пробы — 20 мкл. Хроматографические данные обрабатывали с помощью программы «АльфаСпектр» («ЭкоНова», Новосибирск).
Зависимость концентрации изониазида от времени после инъекции у каждого пациента описывалась графически в исходных и логарифмически преобразованных единицах. Для исследуемого лекарственного средства рассчитывались площадь под фармакокинетической кривой (AUCτ, ss) в стационарных условиях (ss); максимальная (Cmax, ss) и минимальная (Сmin, ss) равновесная концентрация в плазме; время достижения максимальной концентрации в плазме (Tmax); средняя стационарная концентрация в плазме (Сav); разброс концентраций в плазме (DF); период полуэлиминации (T½); константа элиминации (kel); время, в течение которого концентрация превышает Сav (TaboveCav).
Результаты анализировались статистически с помощью программы IBM SPSS STATISTICS 22. Соответствие распределения количественных переменных нормальному закону оценивалась с использованием критерия Шапиро–Уилка. В связи с тем что распределение анализируемых количественных переменных отличалось от нормального, данные представлялись в виде медианы (Ме) и межквартильного (25 и 75%) распределения в формате Ме (Q1; Q3). При сравнении групп в зависимости от типа данных и количества групп использовались критерии Манна–Уитни, Краскела–Уоллиса, Пирсона χ2. Критическое значение уровня статистической значимости различий (р) принимали равным 0,05.
РЕЗУЛЬТАТЫ
Больные, включенные в исследование, не имели статистически значимых демографических и антропометрических различий. До начала интенсивной фазы лечения туберкулеза клиническое состояние пациентов и показатели биохимического анализа крови также не различались.
У больных преобладал инфильтративный туберкулез легких (85/146, 58,22%), реже диагностировались диссеминированный (35/146, 23,97%) и очаговый туберкулез легких (26/146, 17,81%). При рентгенологическом исследовании у 58/146 (39,73%) пациентов было выявлено двустороннее поражение легочной ткани, у 88/146 (60,27%) – одностороннее. У 46/146 (31,51%) больных диагностировали фазу распада. Выделение микобактерий туберкулеза было установлено в 93/146 (63,7%) случаях.
После фармакогенетического исследования и определения типа ацетилирования были выделены 3 подгруппы пациентов:
- группа А1 – 33/146 (22,60%) быстрых ацетиляторов;
- группа А2 – 64/146 (43,84%) промежуточных ацетиляторов;
- группа А3 – 49/146 (33,56%) медленных ацетиляторов.
Гепатотоксическое действие изониазида развивалось у 7/146 (4,79%) быстрых, 5/146 (3,42%) промежуточных и 20/146 (13,7%) медленных ацетиляторов.
В рамках исследования был проведен поиск факторов, способствующих развитию гепатотоксических реакций у пациентов при лечении изониазидом туберкулеза легких. В качестве наиболее вероятных факторов рассматривали однонуклеотидные замены гена NAT2: NAT2*5 (341T>C), NAT2*6 (590G>A), NAT2*7 (857G>A), NAT2*11 (481C>T), NAT2*12 (803A>G), NAT2*13 (282C>T) и типы ацетилирования изониазида (быстрый, медленный и промежуточный). Поиск факторов выполнялся методом бинарной логистической регрессии с оценкой общей значимости регрессионного уравнения и вычислением отношения шансов (ОШ) и его 95% доверительного интервала (ДИ) для каждого включенного предиктора. Оптимальным алгоритмом для построения уравнения логистической регрессии стало пошаговое исключение статистически незначимых предикторов из конечного уравнения с использованием критерия А. Вальда [12]. Все построенные уравнения содержали константу уравнения.
В уравнение включались комбинации генотипов G/A NAT2*7 (857G>A, p=0,0549), A/G NAT2*12 (803A>G, p=0,0414) и T/T NAT2*13 (282C>T; p=0,0006) гена NAT2. Другие генотипы полиморфных вариантов гена NAT2 были пошагово исключены из уравнения как не оказывающие значимого влияния на развитие гепатотоксичности. При определении вероятности лекарственного поражения печени было установлено, что генотипы A/G NAT2*12 (ОШ=2,64; 95% ДИ: 1,04–6,69) и T/T NAT2*13 (ОШ=8,08; 95% ДИ: 2,45–26,72) являются независимыми предикторами развития гепатотоксических реакций при терапии изониазидом.
С учетом значимого влияния генотипов A/G NAT2*12 и T/T NAT2*13 на развитие гепатотоксических реакций определялась прогностическая ценность полученного уравнения с помощью ROC-анализа (Receiver Operating Characteristic). Его результаты подтвердили, что генотипы A/G NAT2*12 и T/T NAT2*13 играют существенную роль в развитии гепатотоксических реакций при лечении изониазидом лекарственно-чувствительного туберкулеза легких. Площадь под ROC-кривой (AUC) составила 0,70 (95% ДИ: 0,62–0,77), что соответствует средней прогностической значимости.
При построении статистически значимого уравнения, описывающего зависимость развития лекарственных поражений печени от типа ацетилирования, учитывали два типа ацетилирования: медленный (p=0,0001) и быстрый (p=0,0630). Методом вычисления ОШ установлено, что вероятность развития гепатотоксических реакций у медленных ацетиляторов возрастала в 8,57 раза по сравнению с быстрыми ацетиляторами (ОШ=8,57; 95% ДИ: 2,92–25,18). При этом быстрый тип ацетилирования не оказывал влияния на развитие гепатотоксичности (ОШ=3,23; 95% ДИ: 0,94–11,13). AUC составила 0,73 (95% ДИ: 0,65–0,80), что соответствует хорошей прогностической значимости. Следовательно, медленный тип ацетилирования служит значимым предиктором появления гепатотоксических реакций при лечении лекарственно-чувствительного туберкулеза легких изониазидом в стандартных дозах.
В фармакогенетическое исследование было включено 35 пациентов: из группы А1 – 8/35 (22,9%) быстрых, из группы А2 – 13/35 (37,1%) промежуточных, из группы А3 – 14/35 (40,0%) медленных ацетиляторов. У 2 (14,3%) пациентов с медленным типом ацетилирования изониазид вызывал головокружение и диспепсические расстройства; эти пациенты были исключены из исследования.
В соответствии с поставленной целью и задачами в процессе исследования определялась концентрация изониазида в образцах плазмы для построения фармакокинетических кривых, рассчитывались показатели фармакокинетики изониазида. Персонализированный анализ фармакокинетических параметров изониазида показал их значительную индивидуальную вариабельность.
При попарном сравнении площади под фармакокинетической кривой (AUCt, ss), средней концентрации в плазме (Сav), разброса концентраций в плазме (DF) и времени, в течение которого концентрация превышает Сav (TaboveCav), уровень достоверности был скорректирован с помощью поправки Бонферрони. Различия считали статистически значимыми при p <0,017. Площадь под фармакокинетической кривой (AUCt, ss) была в 2,5 и 3,3 раза больше у пациентов с медленным типом ацетилирования, чем у больных с промежуточным и быстрым типом (p=0,0132 и p=0,0076 соответственно). Средняя концентрация (Cav) в группе медленных ацетиляторов в 2,5 раза превышала показатель промежуточных ацетиляторов (p=0,0066) и в 3,5 раза показатель быстрых ацетиляторов (p=0,0073). Разброс концентраций изониазида в плазме (DF) был в 1,6 и 2,4 раза меньше у медленных ацетиляторов, чем у больных с промежуточным и быстрым фенотипами ацетилирования (p=0,0002 и p=0,0124 соответственно). У пациентов с промежуточным и быстрым фенотипом ацетилирования эти показатели фармакокинетики не различались (табл.).
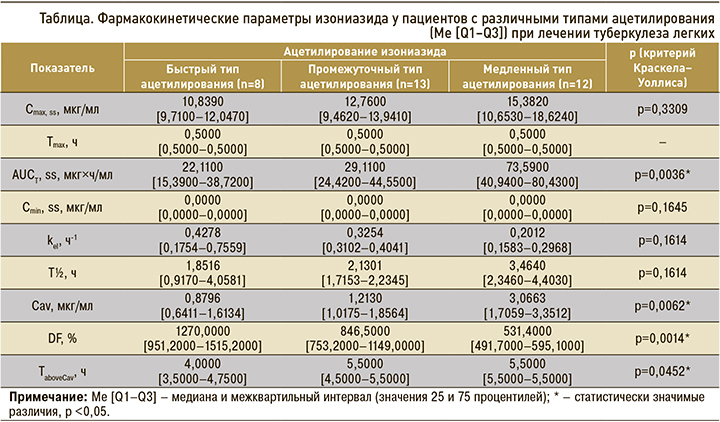
Максимальная и минимальная равновесные концентрации изониазида (Cmax, ss, Сmin, ss), время достижения максимальной концентрации в плазме (Tmax), период полуэлиминации (T½), константа элиминации (kel), время, в течение которого концентрация превышает Сav (TaboveCav), не различались у пациентов с разной скоростью ацетилирования исследуемого лекарственного средства (p >0,05; см. табл.).
ОБСУЖДЕНИЕ
Лечение туберкулеза – это длительный непрерывный прием как минимум четырех противотуберкулезных средств. Частота нежелательных побочных реакций при использовании противотуберкулезных средств первого ряда варьирует от 8,0 до 85,0% [13].
Эффективное и безопасное применение противотуберкулезных средств является актуальной и приоритетной задачей современной фтизиатрии.
Для безопасной противотуберкулезной химиотерапии необходимо выявлять группы пациентов, ассоциированные с повышенным риском развития нежелательных побочных реакций. Это позволит своевременно разрабатывать комплекс мероприятий, направленных на прогнозирование, предотвращение и устранение этих реакций [14]. Данные фармакогенетических исследований давно используются для подбора оптимальной дозы изониазида в зависимости от скорости его ацетилирования [15].
С клинической точки зрения медленный тип ацетилирования более важен, поскольку медленные ацетиляторы по сравнению с быстрыми и промежуточными более подвержены развитию нежелательных побочных явлений.
В нашем исследовании установлена взаимосвязь между носительством полиморфных вариантов гена NAT2 (A/G NAT2*12 и T/T NAT2*13) и развитием гепатотоксичности изониазида. Судя по значениям ОШ, носительство A/G NAT2*12 и T/T NAT2*13 существенно (от 2,5 до 8 раз) повышает вероятность развития лекарственных поражений печени у больных туберкулезом легких.
Скорость ацетилирования изониазида значительно влияет на частоту развития лекарственного поражения печени. У медленных ацетиляторов намного чаще, чем у быстрых и промежуточных ацетиляторов, регистрировались гепатотоксические реакции. Результаты нашего исследования подтверждают данные метаанализов и систематических обзоров о том, что медленный тип ацетилирования – основной предиктор риска развития гепатотоксичности изониазида [1, 5–7]. Полученные данные позволили сделать заключение, что при лечении лекарственно-чувствительного туберкулеза легких необходимо генотипирование пациентов по гену NAT2 для определения тактики лечения изониазидом с целью предупреждения развития лекарственных поражений печени.
Противомикробное действие изониазида зависит от его концентрации в плазме. Она коррелирует со сроками излечения туберкулеза, прекращением выделения микобактерий и формированием их лекарственной устойчивости, частотой развития нежелательных лекарственных реакций [16–18].
По данным фармакокинетического исследования, концентрация изониазида в плазме широко варьирует у пациентов с различными типами ацетилирования.
В группе медленных ацетиляторов установлены высокие значения площади под фармакокинетической кривой (AUCτ, ss), средней концентрации в плазме (Cav) и длительный период полуэлиминации (T½) изониазида. В плазме таких пациентов увеличена концентрация гепатотоксического метаболита изониазида — гидразина [19]. При назначении изониазида медленным ацетиляторам требуются регулярная оценка их клинического состояния и контроль лабораторных показателей для своевременной диагностики нежелательных побочных реакций.
Низкие значения площади под фармакокинетической кривой (AUCτ, ss) и максимальной концентрации в плазме (Сmax, ss) изониазида при быстром типе ацетилирования коррелируют с неудачами лечения туберкулеза и формированием лекарственной устойчивости микобактерий [20, 21]. Высокий разброс концентраций (DF) у быстрых ацетиляторов не позволяет поддерживать постоянную концентрацию изониазида в плазме. По нашим расчетам, для того чтобы уменьшить разброс концентраций, изониазид следует назначать быстрым ацетиляторам не менее 2 раз/сут.
ЗАКЛЮЧЕНИЕ
1. Носительство генотипов A/G NAT2*12 (803A>G) и T/T NAT2*13 (282C>T) гена NAT2 ассоциировано с риском развития гепатотоксических реакций у больных туберкулезом легких.
2. Медленный тип ацетилирования NAT2 является предиктором развития нежелательных побочных реакций со стороны печени при химиотерапии изониазидом туберкулеза легких.
3. У больных туберкулезом легких с медленным типом ацетилирования при участии изофермента N-ацетилтрансферазы 2 площадь под фармакокинетической кривой и средняя концентрация изониазида в плазме выше, чем у пациентов с быстрым типом ацетилирования.
4. Максимальная и минимальная равновесные концентрации, время достижения максимальной концентрации, время, в течение которого концентрация превышает среднюю концентрацию в плазме, константа элиминации, период полуэлиминации изониазида не зависят от типа ацетилирования.


