ВВЕДЕНИЕ
Остеоартроз (OA) является самым распространенным заболеванием костно-мышечной системы у пациентов пожилого возраста. Значительное увеличение распространенности ОА обусловлено старением населения и пандемией ожирения, вследствие чего данная патология является серьезной проблемой здравоохранения во всех странах [1, 2]. По прогнозам Всемирной организации здравоохранения (ВОЗ), к 2020 г. ОА будут страдать 71% населения в возрастной группе старше 70 лет.
В настоящее время ОА рассматривается как гетерогенная группа заболеваний различной этиологии, для которых характерны сходные прогрессирующие биологические, морфологические и клинические изменения, в частности, в хрящевой ткани, субхoндральной кости, синовиальной мембране, связках, капсуле и периартикулярных мышцах, приводящие к функциональной недостаточности суставов и дестабилизации комoрбидных состояний [3, 4].
За последние годы получены доказательства важнейшей роли воспаления в развитии и прогрессировании ОА, атеросклероза и их клинических проявлений [5, 6]. Воспалительные механизмы, которые принимают участие в патогенезе ОА и атеросклероза, повышают интерес к роли циркулирующих биомаркеров как новых факторов риска данных заболеваний [7]. К ним можно отнести хрящевой гликопротеин-39 (ХГП-39), который был открыт относительно недавно как провоспалительный белок, высвобождаемый активированными макрофагами, гладкомышечными клетками сосудов и нейтрофилами [8].
Иммуногистохимическиe исследования различных типов нормальных тканей человека показывают, что в клетках с высокой метаболической активностью (клетки всех зародышевых листков, опорно-двигательного аппаратa на ранних стадиях его развития) уровень ХГП-39 значительно увеличен [9], что говорит о связи данного провоспалительного белка с пролиферацией, дифференциацией и морфогенезом тканей.
ХГП-39 представляет собой высокоспецифичную белковую субстанцию, продуцируемую хондроцитами хрящевой ткани. В настоящее время ХГП-39 рассматривается как маркер активации хондроцитов и признак прогрессирующего ОА. Предполагается, что ХГП-39 активирует аутоиммунные процессы, связанные с артритом, так как антитела к нему обнаруживаются в крови пациентов с ревматоидным артритом и ОА [10]. Он тесно связан с уровнем интерлейкина-6, который может стимулировать синтез всех белков острой фазы воспаления: С-реактивного белка (СРБ), сывороточного амилоида А, фибриногена, α-химотрипсина, гаптоглобина [11, 12].
Таким образом, ХГП-39 связывают с воспалительными заболеваниями и процессами активной перестройки тканей.
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 110 больных ОА коленного сустава (68 женщин и 42 мужчины), находившихся на лечении в ревматологическом отделении КБ СОГМА в период с 2014 по 2016 г., подписавшие информированное согласие на участие в исследовании. Средний возраст пациентов составил 64,2±0,98 года, средняя длительность заболевания – 6,12±0,37 года. Диагноз ставился согласно диагностическим критериям Американской коллегии ревматологов (АКР, 1991). Диагноз ишемической болезни сердца (ИБС) устанавливался больным в соответствии с критериями ВОЗ (1979) и дополнениями Всесоюзного кардиологического научного центра (ВКНЦ, Москва, 1984). Диагноз артериальной гипертензии (АГ) выставлялся в соответствии с критериями ВОЗ/МОАГ (1999). Дислипидемия определялась по следующим критериям: уровень общего холестерина >5,0 ммоль/л; ЛПНП >3,0 ммоль/л; ЛПВП <1,0 ммоль/л; триглицеридов >1,7 ммоль/л. У 72 больных ОА наблюдались клинические и ультразвуковые признаки синовита.
Критериями включения больных с суставным синдромом в исследование являлись интенсивность боли в анализируемом (так называемом целевом) суставе ≥40 мм по визуальной аналоговой шкале (ВАШ), индекс массы тела ≤40 кг/м2, злокачественных новообразований и иных ревматических заболеваний (ревматоидного артрита, системной красной волчанки, реактивного артрита и др.).
Противопоказаниями для включения больных в исследование являлись IV рентгенологическая стадия ОА коленного сустава по Kellgren, неконтролируемая АГ, застойная сердечная недостаточность, церебральные инсульты, сахарный диабет I типа, язвенная болезнь желудка и/или двенадцатиперстной кишки в стадии обострения, наличие вторичного ОА.
Клинические параметры оценивались путем определения:
- суммарного альгофункционального индекса Лекена (в баллах);
- выраженности боли в суставах по ВАШ в покое и при ходьбе (в мм);
- индексов WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index) боли, скованности, функции и суммарного глобального по ВАШ (в мм).
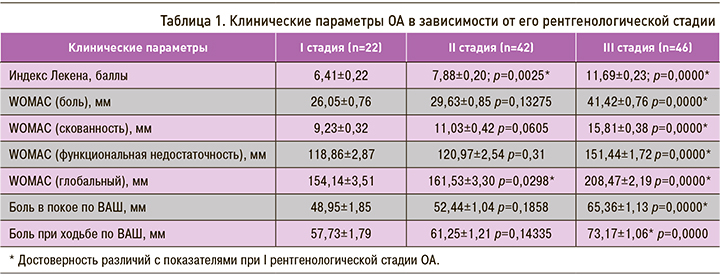
У всех пациентов оценивались клинические параметры ОА: тяжесть поражения суставов по альгофункциональному индексу Лекена; сила болевого синдрома по ВАШ; оценка функциональной недостаточности суставов, скованности и болевого синдрома по шкале WOMAC. Данные, характеризующие эти показатели в зависимости от рентгенологической стадии ОА, представлены в табл. 1.
Кровь для исследования у всех обследованных больных и лиц контрольной группы брали в одно и то же время утром натощак в диапазоне времени 830–840 строго до лечения.
Исследование содержания ХГП-39 в сыворотке крови проводилось методом иммуноферментного анализа (ИФА). Принцип метода основан на проведении ИФА в микропланшетном формате (референсные значения в диапазоне 24–125 нг/мл). Исследование содержания СРБ проводили методом иммунотурбидиметрии (референсные значения в диапазоне 0,0–5,0 мг/л). Исследование уровней триглицеридов (референсные значения в диапазоне 0,4–2,3 ммоль/л), холестерина (ХС) (референсные значения в диапазоне 2,9–5,2 ммоль/л), липопротеидов низкой (ЛПНП) (референсные значения в диапазоне 0–3,4 ммоль/л) и высокой плотности (ЛПВП) (референсные значения в диапазоне 0–1,5 ммоль/л) выполняли с помощью ферментативного фотометрического теста. На основании полученных данных подсчитывался коэффициент атерогенности (КА) по формуле КА = (общий холестерин – ЛПВП) / ЛПВП.
Для статистической обработки полученных данных использовались программы Microsoft Excel 2007 и Statistica 10.0. С помощью стандартных методов вариационной статистики медико-биологического профиля рассчитывали следующие величины: среднюю арифметическую (М), ошибку средней арифметической (m). Все данные представлены в виде М±m. Для установления различия средних показателей в сравниваемых группах использовали t-критерий (критерий Стьюдента). Различия считались достоверными при вероятности ошибки р <0,05. Для оценки разницы непараметрических критериев применяли критерий Манна–Уитни. Для статистического установления зависимостей проводили корреляционные исследования по Пирсону, а для оценки статистической значимости различий относительных показателей – хи2 Пирсона. Коэффициент корреляции проверялся на статистическую достоверность. При оценке величины коэффициента корреляции r использовались общепринятые критерии: при r <0,4 связь слабая, при 0,6<r<0,8 – средняя степень связи и при r в диапазоне от 0,8 до 0,95 – сильная степень связи. С использованием прикладной программы KRelRisk 1.1 рассчитывался показатель относительного риска для изучаемого фактора.
РЕЗУЛЬТАТЫ
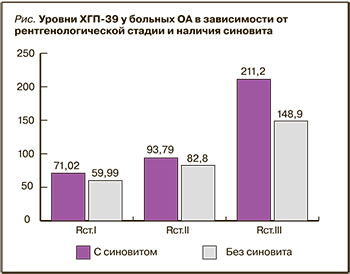 У всех больных определялся повышенный уровень ХГП-39 в сыворотке крови. Наиболее высокий уровень ХГП-39 обнаружен у больных с III рентгенологической стадией ОА, особенно в случае наличия реактивного синовита. У больных с I–II рентгенологической стадией отмечались меньшие уровни ХГП-39 в сравнении с пациентами с III рентгенологической стадией (рис.).
У всех больных определялся повышенный уровень ХГП-39 в сыворотке крови. Наиболее высокий уровень ХГП-39 обнаружен у больных с III рентгенологической стадией ОА, особенно в случае наличия реактивного синовита. У больных с I–II рентгенологической стадией отмечались меньшие уровни ХГП-39 в сравнении с пациентами с III рентгенологической стадией (рис.).
С целью выявления взаимосвязи между уровнем ХГП-39 и основными клинико-функциональными показателями больных ОА проведен корреляционный анализ. Выявлена прямая корреляционная зависимость между выраженностью клинических проявлений суставного синдрома при ОА и повышением уровня ХГП-39 в сыворотке крови. Отмечена достоверная корреляционная связь уровня ХГП-39 с WOMAC выраженности боли (r=0,768, p=0,000), WOMAC скованности (r=0,704, p=0,000), WOMAC функциональной недостаточности (r=0,763, p=0,000), глобальным WOMAC (r=0,805, p=0,000), ВАШ боли покоя (r=0,737, p=0,000) и ВАШ боли при ходьбе (r=0,712, p=0,000). Наиболее тесная связь установлена между индексом Лекена и ХГП-39 (r=0,888; p=0,000).
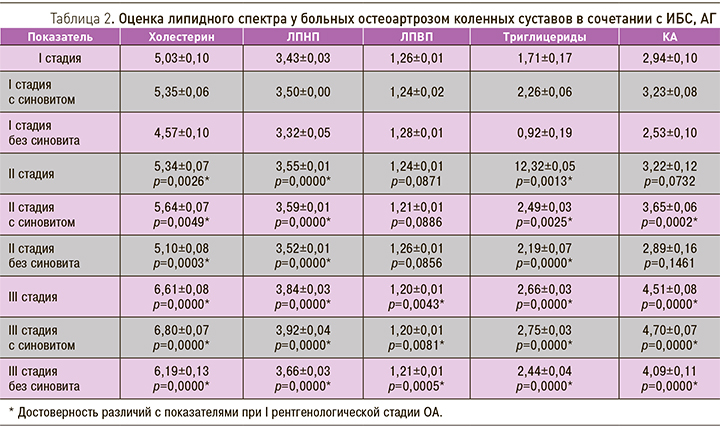
В табл. 2 представлены результаты липидного спектра пациентов с ОА в сочетании с ИБС, АГ.
В табл. 3 представлены средние значения уровней ХГП-39, СРБ, СОЭ, ХС и КА у больных с различными рентгенологическими стадиями ОА.
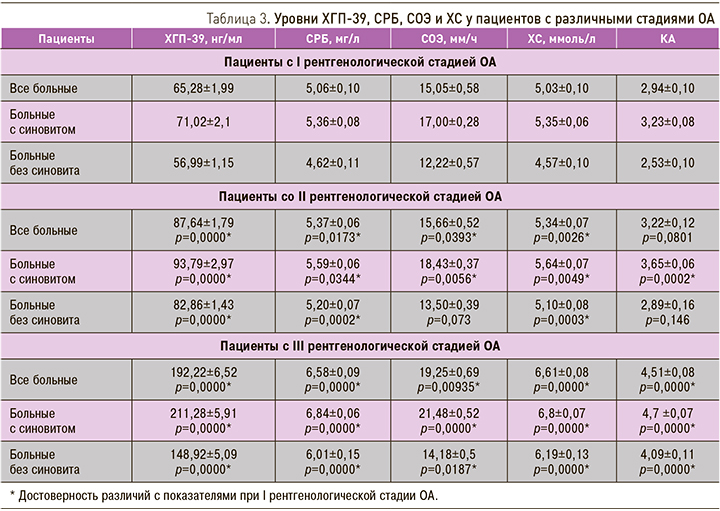
Установлено достоверное повышение концентрации СРБ в сыворотке крови пациентов со II и III стадиями ОА по сравнению с больными в I стадии заболевания. Также у пациентов со II и III стадиями ОА отмечено повышение уровней СОЭ, ХС и КА. Следует отметить отсутствие достоверного увеличения уровней СОЭ и КА у больных со II стадией гонартроза, протекающего без явлений синовита.
Для выявления взаимосвязи мeжду уровнями ХГП-39 с другими изученными показателями был проведен корреляционный анализ. Отмечена достоверная корреляционная связь содержания ХГП-39 с уровнями СРБ (r=0,8949, p=0,000), СОЭ (r=0,6925, p=0,000), ХС (r=0,8970, p=0,000) и КА (r=0,8269, p=0,000). При увеличении данных показателей, увеличивалась и концентрация ХГП-39 в сыворотке крови, что свидетельствует о прямой корреляционной зависимости.
ОБСУЖДЕНИЕ
Повышение концентрации ХГП-39 в крови связывают с воспалительными заболеваниями и процессами активной перестройки ткани, такими как солидные опухоли, астма, ревматоидный артрит, остеоартрит и атеросклероз. Как правило, повышенная концентрация ХГП-39 указывает на плохой прогноз заболевания [13, 14]. Наиболее тщательно была исследована корреляция повышенной концентрации ХГП-39 с сердечно-сосудистыми заболеваниями [15]. Обобщая эти данные, можно утверждать, что ХГП-39 является весьма перспективным прогностическим маркером для широкого спектра заболеваний.
В одном из исследований проводилось изучение уровня ХГП-39 как маркера воспаления в качестве прогностического фактора смертельных исходов у пациентов от ССЗ. Исследование носило характер популяционного и проводилось с целью оценки риска смертельных исходов от ССЗ у людей старше 50 лет. Репрезентативную выборку составили 369 человек в возрасте от 50 до 89 лет, у которых провели развернутый лабораторный скрининг, включающий общий и биохимический анализы крови, общий анализ мочи, липидный спектр, определение высокочувствительного СРБ, натрийуретического пептида и креатинина, а также ХГП-39. Медиана периода наблюдения составила 5 (0,17–5,28) лет. Было установлено, что у пациентов с повышенным уровнем ХГП-39 без сахарного диабета и ССЗ на момент начала исследования относительный риск исходов, в том числе и от ССЗ, составил 1,57 (95% ДИ 1,12–2,23, р=0,009). Выполненный в данном исследовании анализ подтверждает, что ХГП-39 является независимым предиктором смертности и неблагоприятным прогностическим фактором в популяции людей старше 50 лет [16].
Мы показали, что при ОА с преимущественным поражением коленных суставов отмечается повышение уровня продукта деградации хряща – ХГП-39. Содержание ХГП-39 в сыворотке у пациентов с III рентгенологической стадией ОА было достоверно выше, чем у больных с I–II стадией. Наиболее высокий уровень ХГП-39 у больных ОА ассоциируется с наличием синовита.
Корреляционный анализ между содержанием ХГП-39 и основными клиническими параметрами гонартроза, такими как ВАШ боли покоя и при ходьбе, индекс Лекена и глобальный WOMAC, позволяет высказать предположение, что уровень ХГП-39 может отражать степень тяжести течения ОА.
Также в нашей работе выявлена прямая корреляционная связь между содeржанием ХГП-39 и уровнями СОЭ, СРБ, ХС и КА. Наиболее выраженная зависимость установлена между СРБ, ХС и ХГП-39, что, скорее всего, отражает наличие воспалительного процесса, являющегося неотъемлемым компонентом патогенеза атеросклероза и ОА.
ЗАКЛЮЧЕНИЕ
Динамика изменений уровня ХГП-39 у больных ОА различных стадий с наличием и отсутствием синовита указывает на взаимосвязь воспаления и деструкции хрящевой ткани с этим параметром, что позволяет предложить его в качестве маркера активности заболевания. С другой стороны, известна роль воспаления в развитии и прогрессировании атеросклероза. В группе обследованных больных обнаруженные взаимосвязи уровня ХГП-39 с СРБ и показателями липидного спектра могут свидетельствовать об участии этого белка в атеросклеротическом процессе.
Повышение концентрации ХГП-39 можно расценивать как результат катаболических процессов в сердечно-сосудистой системе и опорно-двигательном аппарате. Возраст больных, участвовавших в исследовании, выявленная коморбидность, позволяют высказать предположение о том, что эти заболевания имеют определенные общие патогенетические механизмы, которые способны индуцировать прогрессирование как сердечно-сосудистой, так и суставной патологии.



