ВВЕДЕНИЕ
Ревматоидный артрит (РА) – аутоиммунное заболевание неизвестной этиологии, проявляющееся хроническим эрозивным артритом и приводящее к ранней инвалидизации и уменьшению продолжительности жизни [1]. Основной причиной преждевременной смертности при данном заболевании является сердечно-сосудистая патология, обусловленная атеросклеротическим процессом [2]. Разработка новых предикторов сердечно-сосудистого риска (ССР) у пациентов данной категории представляет собой актуальную задачу.
Одним из таких предикторов может служить нарушение функции почек, даже на субклинической стадии [3]. В качестве ранних маркеров повреждения почек могут выступать показатели канальцевой дисфункции [4]. При ряде заболеваний поражение проксимальных канальцев опережает повреждение клубочкового аппарата [5]. Альбуминурия – широко известный маркер раннего повреждения почек и ССР – в настоящее время рассматривается не только как результат повышенной проницаемости клубочковой мембраны, но и снижения реабсорбции альбумина в проксимальных канальцах [6]. Имеются данные о возможном использовании показателей тубулярного повреждения в качестве маркеров ССР [7], в том числе при ревматических заболеваниях [8].
В настоящее время канальцевая дисфункция у пациентов с РА изучена недостаточно, тем более в качестве маркера ССР у пациентов данной категории. В связи с этим представляет несомненный интерес изучение связей между тубулярной дисфункцией, особенностями течения РА и традиционными факторами кардиоваскулярного риска.
МАТЕРИАЛ И МЕТОДЫ
Исследование проведено на базе ревматологического отделения ГУЗ «Областная клиническая больница» (Саратов). В исследование были включены 73 пациента с РА в возрасте от 18 до 60 лет. Диагноз РА устанавливался на основании диагностических критериев ACR/EULAR 2010 г. Критерии исключения: любые сопутствующие заболевания почек, протеинурия выше 300 мг/ сут, скорость клубочковой фильтрации (СКФ) по CKD-EPI менее 60 мл/мин/1,73 м²; заболевания, сопровождающиеся развитием вторичной нефропатии; артериальная гипертензия (АГ) с ассоциированными клиническими состояниями, тяжелые сопутствующие заболевания в фазе обострения, онкологическая патология, беременность.
 В группу сравнения были включены 36 добровольцев (30 женщин, 6 мужчин, средний возраст 45 [35–56] лет), не имеющих сопутствующих заболеваний почек, без АГ или с контролируемой АГ без ассоциированных клинических состояний. Лица группы сравнения были сопоставимы с пациентами основной группы по возрасту, индексу массы тела (ИМТ), половому распределению, уровню артериального давления (АД).
В группу сравнения были включены 36 добровольцев (30 женщин, 6 мужчин, средний возраст 45 [35–56] лет), не имеющих сопутствующих заболеваний почек, без АГ или с контролируемой АГ без ассоциированных клинических состояний. Лица группы сравнения были сопоставимы с пациентами основной группы по возрасту, индексу массы тела (ИМТ), половому распределению, уровню артериального давления (АД).
Пациентам проводилось общеклиническое обследование. Рентгенологическая стадия РА определялась по классификации Штейнброкера. Оценка активности проводилась на основании индекса DAS28. Определяли концентрацию С-реактивного белка (вчСРБ) плазмы крови высокочувствительным турбидиметрическим методом с применением реагентов DiaSys (Германия). С целью оценки функциональной активности пациентов с РА использовали классификацию ACR (1991), опросник состояния здоровья HAQ и индекс функциональной активности пациента с ревматоидным артритом (PAS).
Среди пациентов преобладали женщины – 61 (84%). Медиана возраста пациентов составила 48 (36–54) лет. Преобладали серопозитивные по ревматоидному фактору (РФ) пациенты с умеренной и высокой активностью процесса, III рентгенологической стадией по Штейнброкеру, III функциональным классом (табл. 1).
Для выявления канальцевой дисфункции исследовали уровень α1-микроглобулина (α1-Мг) и ферментурии – гаммаглутаминтранспептидазы (ГГТП) и лактатдегидрогеназы (ЛДГ) в разовой порции мочи. Мочевую экскрецию альбумина (Ал) и α1-Мг определяли иммунотурбидиметрическим методом с использованием реактивов APTEC Diagnostics (Бельгия) на анализаторе BM/Hitachi 912 Analyzer. Рассчитывали отношение «альбумин/креатинин» (Ал/Кр) и «α1-Мг/креатинин» (α1-Мг/Кр) утренней порции мочи (мг/г креатинина). Определение содержания ГГТП и ЛДГ в моче проводили на анализаторе BM/Hitachi 912 Analyzer с использованием реагентов «Диакон-ДС» (Россия). Исследовали утреннюю порцию мочи, показатели пересчитывали на 1 ммоль креатинина мочи. СКФ определяли по формуле CKD-EPI в мл/мин/1,73 м2.
У всех пациентов была проведена оценка традиционных факторов ССР: АГ, дислипидемия, избыточная масса тела (ИМТ>=25 кг/ м²), курение [9]. Определяли уровни общего холестерина (ОХ), липопротеидов высокой плотности (ЛПВП), триглицеридов (ТГ). Уровень липопротеидов низкой плотности (ЛПНП) рассчитывали по формуле: ЛПНП=ОХ-ТГ/2,2-ЛПВП. Концентрации ОХ >4,9 ммоль/л, ЛПНП >3 ммоль/л, ЛПВП <1,2 ммоль/л у женщин и <1,0 ммоль/л у мужчин, ТГ >1,7 ммоль/л, индекс атерогенности (ОХ-ЛПВП)/ЛПВП) >4 у.е., отношение ОХ/ЛПВП >5 у.е. расценивались как дислипидемия [9, 10]. Для оценки суммарного ССР использовали европейскую шкалу SCORE и прогностическую шкалу риска развития ССО – RRS (Reynolds Risk Score) в модификации EULAR.
Статистическая обработка данных проводилась с использованием программы Statistica 6.0 (StatSoft Inc., США). Нормально распределенные количественные признаки представлены в виде M±SD, где М – среднее арифметическое, SD – стандартное отклонение. Признаки, распределение которых отличалось от нормального, были представлены в виде медианы (Me) [25-й; 75-й перцентили]. Для сравнения двух групп с нормальным распределением признака определяли t-тест Стьюдента; при изучении показателей с распределением, отличающимся от нормального, применялся критерий Манна–Уитни. Для оценки связи между показателями использовался корреляционный анализ с расчетом коэффициента Спирмена. Сравнение относительных частот в двух группах проводилось при построении таблицы 2×2 (точный двусторонний критерий Фишера, χ²-критерий с поправкой Йетса). Различия и корреляционные взаимосвязи считали статистически значимыми при p <0,05.
РЕЗУЛЬТАТЫ
Концентрация α1-Мг, Ал в моче у пациентов с РА было значимо выше, чем у лиц группы сравнения (табл. 2). Пациенты и лица группы сравнения были сопоставимы по возрасту, ИМТ, уровням систолического (сАД) и диастолического (дАД) АД на момент исследования уровню ОХ. Повышение мочевой экскреции (Ал/Кр ≥30 мг/г) [11] выявлено у 52 (71%) пациентов с РА.
 У пациентов с длительностью РА до 1 года значимо выше, чем у лиц сравнения, была только концентрация α1-Мг (p <0,05). При длительности РА от 1 года до 5 лет и от 5 до 10 лет концентрации α1-Мг (p <0,01) и Ал (p <0,01) была выше, чем у лиц группы сравнения. При продолжительности РА более 10 лет содержание всех исследуемых микропротеинов (p <0,01) и ферментов мочи (p <0,05) было выше, чем у лиц группы сравнения. Пациенты всех групп были сопоставимы с лицами группы сравнения по возрасту, ИМТ, уровням АД, ОХ.
У пациентов с длительностью РА до 1 года значимо выше, чем у лиц сравнения, была только концентрация α1-Мг (p <0,05). При длительности РА от 1 года до 5 лет и от 5 до 10 лет концентрации α1-Мг (p <0,01) и Ал (p <0,01) была выше, чем у лиц группы сравнения. При продолжительности РА более 10 лет содержание всех исследуемых микропротеинов (p <0,01) и ферментов мочи (p <0,05) было выше, чем у лиц группы сравнения. Пациенты всех групп были сопоставимы с лицами группы сравнения по возрасту, ИМТ, уровням АД, ОХ.
У пациентов старше 40 лет при I степени активности только соотношение α1-Мг/Кр было выше, чем у лиц группы сравнения (p <0,05), при II степени активности – значения α1-Мг/Кр и Ал/Кр (p <0,01), при III степени значения всех исследуемых показателей у пациентов с РА выше, чем у лиц группы сравнения (α1-Мг/Кр и Ал/Кр; p <0,01, ГГТП/Кр и ЛДГ/Кр; p <0,05).
Концентрация Ал и ГГТП в моче у пациентов с III ФК была значимо выше, чем у пациентов с I ФК (p=0,035 и p=0,044 соответственно). При анализе концентрации α1-Мг и ЛДГ в моче в зависимости от ФК определяется тенденция увеличения значений показателей по мере нарастания функциональной недостаточности (p=0,068 и p=0,076 соответственно). Пациенты сравниваемых групп были сопоставимы по возрасту, длительности РА, уровням АД, ИМТ, ОХ. У пациентов с I ФК все значения показателей были сопоставимы с таковыми у лиц группы сравнения, а у пациентов II и III ФК все значения показателей были выше, чем у лиц группы сравнения (p <0,05). Выявлены связи между α1-Мг/Кр и индексами HAQ (r=0,447; p=0,048) и PAS (r=0,450; p=0,046), между Ал/Кр и индексом HAQ (r=0,421; p=0,048).
У пациентов с эрозивными изменениями значение Ал/Кр было достоверно больше, чем у больных без эрозивных изменений (p <0,05). У пациентов без эрозивных изменений в суставах только содержание α1-МГ было выше, чем у лиц группы сравнения (p <0,05), а у пациентов с эрозивными процессами в суставах значения всех исследуемых показателей были выше, чем у лиц группы сравнения (α1-Мг/Кр и Ал/Кр; p <0,01, ГГТП/Кр и ЛДГ/Кр; p <0,05). Выявлены статистически значимые различия в концентраций α1-Мг и Ал у пациентов старше 40 лет с I и III рентгенологическими стадиями (α1-Мг/Кр – 23,22 [16,01–31,95] и 37,57 [27,01–57,09] мг/г соответственно; p=0,002; Ал/ Кр – 39,02 [21,34–76,36] и 82,61 [50,27–209,13] мг/г соответственно; p=0,024). Пациенты сравниваемых групп были сопоставимы по основным параметрам. Выявлена связь между рентгенологической стадией РА и α1-Мг/Кр у пациентов старше 40 лет (r=0,407; p=0,005).
У пациентов с системными проявлениями РА значение ЛДГ/Кр было значимо больше, чем у пациентов, не имеющих системных проявлений (5,03 [3,14–9,19] и 2,02 [1,10–4,29] Ед/ммоль соответственно; р=0,001). Больные сравниваемых групп были сопоставимы по возрасту, длительности заболевания, ИМТ, уровню АД, индексам DAS28, PAS. У серопозитивных по РФ пациентов были более высокие концентрации Ал (p=0,001), α1-Мг (p<0,001) и ЛДГ (p=0,019) в моче, чем у лиц группы сравнения. У серонегативных пациентов было отмечено повышение лишь Ал/Кр (p=0,041).
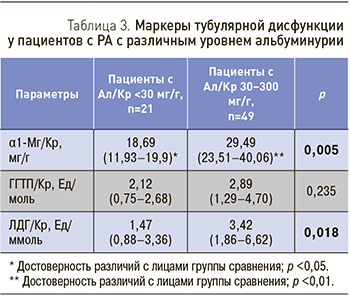 При сравнении концентраций α1-Мг, ГГТП, ЛДГ в моче у пациентов с РА и у лиц группы сравнения с нормальной экскрецией Ал (<30мг/г креатинина) [11] выявлено, что у пациентов даже c нормальной экскрецией Ал содержание α1-Мг выше, чем у лиц группы сравнения (табл. 3).
При сравнении концентраций α1-Мг, ГГТП, ЛДГ в моче у пациентов с РА и у лиц группы сравнения с нормальной экскрецией Ал (<30мг/г креатинина) [11] выявлено, что у пациентов даже c нормальной экскрецией Ал содержание α1-Мг выше, чем у лиц группы сравнения (табл. 3).
СКФ у большинства пациентов (58%) находилась в диапазоне от 60 до 89 мл/мин/1,73 м². Средняя СКФ у пациентов с РА составила 88,43±16,13 мл/ мин/1,73 м², у лиц группы сравнения – 93,54±15,22 мл/мин/1,73 м² (р=0,063).
Традиционные факторы риска у пациентов с РА. АГ диагностирована у 48 (65,7%) обследованных пациентов. У лиц группы сравнения АГ выявлена у 11 (30%) человек, что значимо реже, чем у обследованных пациентов с РА (χ²-критерий с поправкой Йетса=10,65; p=0,001). На момент обследования медиана сАД у больных РА составила 123 (114–137) мм рт ст., дАД – 77,61±11,08 мм рт.ст.; у лиц группы сравнения – сАД 120 (114,5–129,5) мм рт.ст., дАД – 76,52±8,38 мм рт. ст. соответственно (p >0,05).
Уровень ОХ у пациентов с РА был значимо выше, чем у лиц группы сравнения, сопоставимых по возрасту, ИМТ, уровню сАД и дАД (5,32±1,21 и 4,57±0,55 ммоль/л соответственно; p <0,001). Даже у молодых пациентов (до 40 лет) с РА уровень ОХ в сыворотке был выше, чем у лиц без артрита (5±1,15 и 4,14±0,21 ммоль/л; р=0,027), сопоставимых по ИМТ, уровню АД. Наличие хотя бы одного компонента дислипидемии было обнаружено у 68% пациентов и у 33% лиц группы сравнения (χ²-критерий с поправкой Йетса=9,75; p=0,001). Наиболее часто (82%) встречалась дислипидемия, обусловленная повышением проатерогенных фракций (ЛПНП). Выявлены связи между уровнями вчСРБ и ЛПВП (r=-0,328; p=0,015), концентрацией РФ в крови и уровнем ОХ (r=0,431; р=0,006), уровнем ЛПНП (r=0,410; p=0,024), уровнем ТГ (r=0,438; p=0,008). У пациентов с системными проявлениями РА значения показателей липидного обмена были выше, чем у пациентов без системных проявлений (ОХ – 5,77±1,12 и 5,08±1,17 ммоль/л соответственно; р=0,017; ЛПНП – 3,87±1,0 и 2,96±0,96 ммоль/л; р=0,006).
У пациентов с РА средние значения ССР по шкалам SCORE и RRS были сопоставимы со значениями ССР у лиц группы сравнения. Не было выявлено различий по значениям ССР в зависимости от наличия системных проявлений и активности РА.
Маркеры почечной дисфункции и факторы кардиоваскулярного риска у пациентов с РА. У больных РА при наличии АГ соотношение ГГТП/Кр был выше, чем у пациентов без АГ (р=0,035), различия по уровню ЛДГ были близки к значимым (p=0,059). Однако пациенты не были сопоставимы по возрасту, ИМТ, ОХ и показателям липидограммы. Выявлены связи между значениями маркеров канальцевой дисфункции и уровнем АД на момент исследования: cАД и α1-Мг/Кр (r=0,254; p=0,049); сАД и ГГТП/Кр (r=0,312; p=0,015); сАД и ЛДГ/Кр (r=0,281; p=0,029); дАД и α1-Мг/Кр (r=0,278; p=0,031); дАД и ГГТП/Кр (r= 0,260; p=0,045).
У пациентов РА старше 50 лет без АГ уровни Ал (р=0,036) и α1-МГ(р=0,036) в моче были выше, чем лиц группы сравнения, а у пациентов этого же возраста при наличии АГ были значимо повышены уровни Ал (р=0,011), α1-МГ (р <0,001), ГГТП (р=0,020), ЛДГ (р=0,027).
У пациентов выявлены связи между значениями различных маркеров канальцевого повреждения и параметрами липидного профиля: α1-Мг/Кр и ТГ (r=0,268; p-0,048); ГГТП/Кр и ТГ (r=0,277; p=0,032); ЛДГ/Кр и ЛПНП (r=0,346; p=0,008); ЛДГ/Кр и ИА (r=0,335; p=0,012). У больных с индексом атерогенности >4 у.е. уровни в моче α1-МГ и ЛДГ были значимо выше, чем у пациентов с нормальным индексом. Содержание α1-Мг/Кр составило 37,45 (30,84–51,41) и 26,60 (15,30–40,98) мг/г соответственно (р=0,049), ЛДГ/Кр – 5,18 (3,83–8,91) и 2,43 (1,21–5,65) Ед/ммоль (р=0,012). Подобные тенденции выявлены и для уровней ГГТП (р=0,079) и Ал (р=0,075). Однако необходимо отметить, что пациенты значимо отличались и по другим традиционным факторам ССР (возраст, ИМТ, АД).
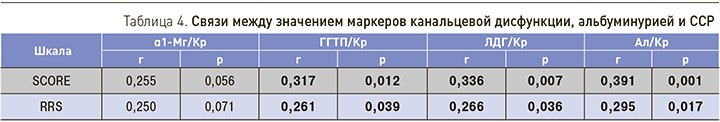
Выявлены связи между уровнями альбуминурии, ферментурии и значением ССР у пациентов старше 40 лет (табл. 4). У пациентов общей группы взаимосвязи близки к статистически значимым.
При проведении корреляционного анализа выявлены связи между СКФ и факторами ССР: ИМТ (r=-0,414; p <0,001), ОХ (r=-0,402; p <0,001), ЛПНП (r=-0,331; p=0,013), риском сердечно-сосудистых осложнений по шкалам RRS (r=-0,341; p=0,031) и Score (r=-0,529; p <0,001). Выявлена взаимосвязь СКФ с альбуминурией (r=-0,335; p=0,020).
ОБСУЖДЕНИЕ
Таким образом, значения маркеров канальцевой дисфункции у пациентов с РА значимо выше, чем у лиц группы сравнения. Наибольшая выраженность тубулярной дисфункции выявлена у серопозитивных пациентов, с длительностью РА более 10 лет, высокой активностью артрита, выраженными структурными изменениями суставов, низким функциональным статусом. Наиболее ранним из изученных маркеров тубулярного поражения почек, по-видимому, является α1-Мг: его концентрация в моче повышена даже у пациентов с длительностью РА менее 1 года и с нормальным уровнем альбуминурии. Повышение мочевой экскреции Ал было выявлено у 71% пациентов с РА без клинических проявлений сердечно-сосудистых заболеваний, что значимо чаще, чем у лиц группы сравнения. Высокая встречаемость повышения альбуминурии отмечена и в работах других авторов [12]. Повышение экскреции Ал с мочой наиболее выражено у пациентов с длительностью заболевания более 10 лет, выраженными структурными изменениями суставов, низким функциональным статусом.
Наиболее значимыми и часто встречающимися традиционными факторами ССР у обследованных пациентов с РА явились АГ и дислипидемия. При изучении липидного профиля пациентов с РА установлено, что наиболее часто встречается дислипидемия, обусловленная повышением уровня проатерогенных фракций (ЛПНП). Наибольшая выраженность липидных изменений выявлена у пациентов с высокой концентрацией РФ в крови, имеющих системные проявления артрита. Высокая активность РА сопряжена со снижением уровня ЛПВП. Оценка риска развития кардиоваскулярных событий (фатальных и нефатальных) в течение 10 лет по шкалам SCORE и RRS не выявила значимых отличий у пациентов и у лиц группы сравнения даже после поправки расчета ССР, рекомендованной EULAR. То есть стратификация ССР у пациентов с РА, основанная только на оценке традиционных факторов риска, может привести к недооценке истинного риска развития сердечно-сосудистых заболеваний. В связи с этим необходимо учитывать и другие маркеры неблагоприятного кардиоваскулярного прогноза у данных пациентов.
В ходе исследования были выявлены связи между выраженностью канальцевой дисфункции, альбуминурией, СКФ и традиционными факторами ССР. Наиболее значимые ассоциации выявлены с АГ и дислипидемией. Нередко у пациентов выявлялись несколько факторов риска сердечно-сосудистых заболеваний (АГ, дислипидемия, избыточная масса тела), что было сопряжено с более выраженной канальцевой дисфункцией и альбуминурией. У пациентов с РА при наличии АГ выраженность тубулярного повреждения больше, чем у пациентов без АГ при прочих равных условиях. Выявлены связи между значениями маркеров почечной дисфункции и значениями шкал ССР, основанных на оценке традиционных факторов риска и выраженности воспаления. По-видимому, накопление с возрастом традиционных факторов риска сопряжено и с прогрессированием почечной дисфункции. Нарушение функции почек, в свою очередь, усугубляет выраженность неблагоприятных факторов, прежде всего АГ и дислипидемии, увеличивая риск кардиоваскулярной смертности.
ЗАКЛЮЧЕНИЕ
Таким образом, учет функционального состояния почек крайне важен для стратификации риска кардиоваскулярных осложнений у пациентов с РА. В качестве почечных маркеров кардиоваскулярного риска у пациентов с РА, помимо таких традиционных факторов, как СКФ и альбуминурия, могут использоваться показатели канальцевой дисфункции. По-видимому, наиболее ранним из изученных маркеров поражения почек и почечным фактором кардиоваскулярного риска является показатель канальцевой дисфункции – α1-Мг. Учитывая полученные результаты, требуется дальнейшее изучение данной проблемы, определение взаимосвязей почечных маркеров кардиоваскулярного риска, в том числе показателей канальцевого поражения, с субклиническим атеросклерозом и жесткостью сосудистой стенки.


