ВВЕДЕНИЕ
Анемия – клинико-лабораторный синдром, характеризующийся уменьшением количества эритроцитов и/или концентрации гемоглобина (Hb) в единице объема крови. Согласно критериям Всемирной организации здравоохранения (ВОЗ), анемия устанавливается при снижении уровня Hb <130 г/л у мужчин и 120 г/л у женщин [1]. В зависимости от уровня Hb выделяют три степени тяжести анемического синдрома: легкую (100–119 г/л у женщин и 100–129 г/л у мужчин), умеренную (80–99 г/л) и тяжелую (<80 г/л).
 По данным ВОЗ (2010), 1,9 млрд (27,9%) населения земного шара страдают анемией. В Российской Федерации ежегодно регистрируется около 1 млн 360 тыс. случаев анемии. Среди госпитализированных пациентов число больных с анемией составляет 20–80% [2, 3].
По данным ВОЗ (2010), 1,9 млрд (27,9%) населения земного шара страдают анемией. В Российской Федерации ежегодно регистрируется около 1 млн 360 тыс. случаев анемии. Среди госпитализированных пациентов число больных с анемией составляет 20–80% [2, 3].
Анемия является частым гематологическим нарушением при ряде ревматических заболеваний. Частота встречаемости анемического синдрома у пациентов с ревматоидным артритом варьирует от 30 до 70% [4, 5]. Анемия у больных ревматоидным артритом коррелирует с активностью и длительностью заболевания, функциональным статусом пациента, способствует снижению качества жизни и ухудшению течения основного процесса, ограничивает возможности медикаментозной терапии [4, 6].
Спондилоартриты (СпА) – группа хронических воспалительных заболеваний, характеризующихся поражением крестцово-подвздошных сочленений, позвоночника, периферических суставов по типу моно- или олигоартрита, энтезисов, а также нередко сопровождающихся внесуставными проявлениями – увеитом, псориазом, воспалительными заболеваниями кишечника [7]. Несмотря на высокую распространенность СпА в популяции, данные о встречаемости и особенностях анемического синдрома при этом заболевании ограничены.
Цель исследования – изучение встречаемости и особенностей анемии у пациентов со СпА, определение ее взаимосвязи с клинико-лабораторными показателями этого заболевания.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 110 пациентов со СпА, отвечающих критериям ASAS (Assessment of Spondyloarthritis International Society) для аксиального [8] или периферического [9] СпА, находившиеся на стационарном лечении в ревматологическом отделении ГУЗ «Областная клиническая больница» (г. Саратов) в 2017–2018 гг. Средний возраст больных составил 43,27±11,1 года, продолжительность СпА – 16,59±9,85 года, 68 (61,8%) больных – мужчины. Нозологическая структура СпА и основные характеристики пациентов, включенных в исследование, представлены в табл. 1.
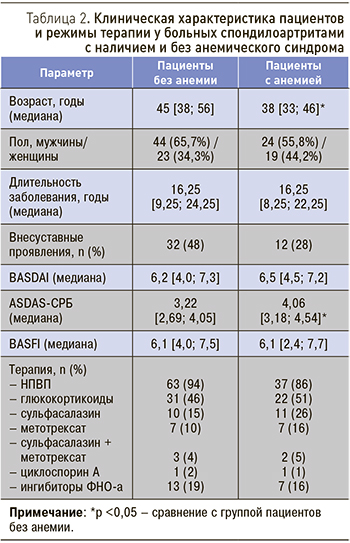 Для оценки активности заболевания для всех пациентов рассчитывали индекс BASDAI (the Bath Ankylosing Spondylitis Disease Activity Index), медиана которого составила 6,25 [4,1; 7,3]. Низкая активность установлена у 25 (22,7%) пациентов, высокая – у 85 (77,4%). Дополнительно для больных анкилозирующим спондилитом (АС) и нерентгенологическим аксиальным СпА (НРА-СА) рассчитывали индекс ASDAS (the Ankylosing Spondylitis Disease Activity Score) с использованием С-реактивного белка (СРБ); среднее значение показателя составило 3,47 [2,95; 4,34], при этом высокая активность зарегистрирована у 78 (91,8%) из 85 пациентов. При расчете индекса BASFI (the Bath Ankylosing Spondylitis Functional Index) выраженные функциональные нарушения имелись у 61 (71,8%) пациента с АС и НРА- СпА.
Для оценки активности заболевания для всех пациентов рассчитывали индекс BASDAI (the Bath Ankylosing Spondylitis Disease Activity Index), медиана которого составила 6,25 [4,1; 7,3]. Низкая активность установлена у 25 (22,7%) пациентов, высокая – у 85 (77,4%). Дополнительно для больных анкилозирующим спондилитом (АС) и нерентгенологическим аксиальным СпА (НРА-СА) рассчитывали индекс ASDAS (the Ankylosing Spondylitis Disease Activity Score) с использованием С-реактивного белка (СРБ); среднее значение показателя составило 3,47 [2,95; 4,34], при этом высокая активность зарегистрирована у 78 (91,8%) из 85 пациентов. При расчете индекса BASFI (the Bath Ankylosing Spondylitis Functional Index) выраженные функциональные нарушения имелись у 61 (71,8%) пациента с АС и НРА- СпА.
На момент исследования нестероидные противовоспалительные препараты (НПВП) принимали 100 (90,9%) больных СпА. Системную терапию глюкокортикоидами в дозе 2,5–40 мг/сут по преднизолону получали 53 (48,2%) пациента. Терапию базисными противовоспалительными препаратами получали 62 (56,4%) больных. Наиболее часто использовался сульфасалазин у 21 (33,9%) пациента, метотрексат – у 13 (21,0%), комбинация сульфасалазина и метотрексата – у 5 (8,1%), циклоспорин А – у 2 (3,2%) больных. Терапия генно-инженерными биологическими препаратами проводилась у 20 (18,2%) пациентов, из них у 12 больных ингибиторы фактора некроза опухоли α (ФНО-α) были назначены в комбинации с сульфасалазином и метотрексатом или одним сульфасалазином (табл. 2).
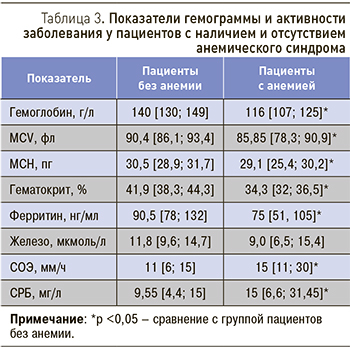
У всех пациентов со СпА производилась оценка гемограммы с подсчетом эритроцитарных индексов (MCV – средний объем эритроцита, MCH – среднее содержание гемоглобина в эритроците, MCHC – средняя концентрация гемоглобина в эритроците, RDW – ширина распределения эритроцитов по объему), острофазовых показателей (СРБ, СОЭ). У 59 пациентов (из них у 37 пациентов с анемией) исследованы показатели феррокинетики (железо сыворотки, общая железосвязывающая способность сыворотки, трансферрин, ферритин, насыщение трансферрина железом [НТЖ]).
 Статистическую обработку данных проводили с использованием программ Microsoft Exсel 2013, Statistica 8.0. Нормальное распределение определяли с помощью критериев Шапиро–Уилка и Колмогорова–Смирнова. Для признаков с нормальным распределением указано среднее значение признака и среднее квадратичное отклонение (M±SD); для описания распределения признаков, отличающегося от нормального, приведены медиана, верхний и нижний квартили – Ме [Q25; Q75]. Оценка достоверности различий между независимыми группами проводилась с использованием критерия Манна–Уитни. Корреляционная связь определялась методом Спирмена.
Статистическую обработку данных проводили с использованием программ Microsoft Exсel 2013, Statistica 8.0. Нормальное распределение определяли с помощью критериев Шапиро–Уилка и Колмогорова–Смирнова. Для признаков с нормальным распределением указано среднее значение признака и среднее квадратичное отклонение (M±SD); для описания распределения признаков, отличающегося от нормального, приведены медиана, верхний и нижний квартили – Ме [Q25; Q75]. Оценка достоверности различий между независимыми группами проводилась с использованием критерия Манна–Уитни. Корреляционная связь определялась методом Спирмена.
Все пациенты дали письменное информированное согласие на участие в исследовании. Исследование одобрено этическим комитетом ФГБОУ ВО «Саратовский ГМУ им. В.И. Разумовского» Минздрава России.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе проведенного исследования анемия выявлена у 43 (39,1%) пациентов. У 38 (88,4%) из них преобладала анемия легкой степени, только у 5 (11,6%) пациентов диагностирована анемия средней степени тяжести, случаев тяжелой анемии со снижением Hb <80 г/л не зарегистрировано. Пациенты со СпА и наличием анемического синдрома были моложе в среднем на 7 лет (p=0,0022), мужчины среди них составили 55,8%, женщины – 44,2%, у 12 (28%) больных имелись внесуставные проявления СпА (см. табл. 2). Достоверных различий в концентрации Hb у мужчин и женщин не выявлено: средняя концентрация Hb у мужчин составила 122,5 [109,5; 126] г/л, у женщин – 110 [107; 117] г/л.
Показатели MCH, MCV, гематокрит, уровень ферритина в сыворотке крови были достоверно ниже у пациентов с анемией. В то же время при наличии анемического синдрома регистрировались более высокая СОЭ и более высокий уровень СРБ (табл. 3).
Микроцитарная анемия со значением MCV <80 фл установлена у 13 (30,2%) пациентов, из них у 12 больных отмечена гипохромия эритроцитов (MCH <26 пг). В 29 (66,6%) случаях анемия имела нормохромный нормоцитарный характер (MCV 80–100 фл, MCH 26–32 пг). У 1 (2,3%) пациента диагностирована макроцитарная анемия, у 28 (65,1%) – анизоцитоз (RDW >14%).
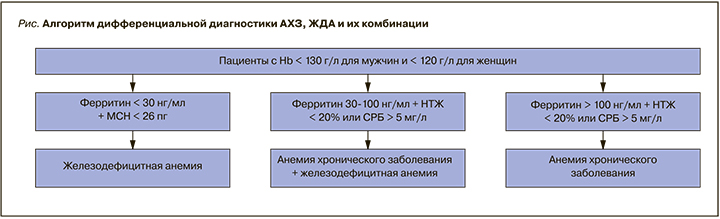
Для СпА характерно персистирующее системное воспаление, сопровождающееся цитокиновым дисбалансом с увеличением продукции ряда провоспалительных цитокинов – ФНО-a, интерлейкинов 1b, 6, 8, 17А [10–12]. Известно, что в патогенезе анемии хронического заболевания (АХЗ) ключевое место занимает гиперпродукция интерлейкина-6, приводящая к увеличению синтеза гепсидина и последующему развитию функционального перераспределительного дефицита железа [13, 14]. Обычно для АХЗ характерна нормохромная нормоцитарная анемия, однако при наличии истинного железодефицита анемия приобретает более гипохромный характер, развивается микроцитоз. Для АХЗ типично повышение в сыворотке крови острофазовых показателей – уровней СРБ и гаптоглобина, СОЭ [13].
У пациентов с нормо- и микроцитарным типами анемии проводилась дифференциальная диагностика между АХЗ, железодефицитной анемией (ЖДА) и их комбинацией. АХЗ устанавливалась при снижении уровня Hb <130 г/л у мужчин и <120 г/л у женщин, повышении уровня СРБ и/ или снижении НТЖ <20% при уровне ферритина в сыворотке >100 нг/мл. Сочетание АХЗ и истинной ЖДА предполагалось при наличии повышения СРБ и/или снижении НТЖ <20% при уровне ферритина 30–100 нг/мл. Истинная ЖДА устанавливалась в случае снижения ферритина в сыворотке <30 нг/мл и MCH <26 пг (рисунок) [15].
На основании изменения показателей обмена железа у 11 (29,7%) пациентов выявлена АХЗ, а у 26 (70,3%) отмечено сочетание АХЗ и ЖДА. Изолированная ЖДА у пациентов со СпА не зарегистрирована.
У больных СпА отсутствовала взаимосвязь между уровнем Hb и клиническим индексом активности BASDAI, а также индексом BASFI, отражающим функциональный статус пациента. Композитный индекс ASDAS-СРБ был достоверно выше (p=0,0245) у пациентов с анемией (см. табл. 2). Нарастание активности системного воспаления, определяемое по изменению величины лабораторных маркеров (СОЭ и уровня СРБ), достоверно коррелировало со снижением концентрации Hb (r=-0,50 и r=-0,33 соответственно; p <0,05).
ЗАКЛЮЧЕНИЕ
Анемия выявлена более чем у трети пациентов со СпА, из них в 88,4% случаев зарегистрирована анемия легкой степени. У 70,3% пациентов выявлена анемия смешанного генеза (АХЗ и ЖДА). Снижение уровня гемоглобина было взаимосвязано с увеличением СОЭ и уровня СРБ, но не было связано с величиной индексов BASDAI и BASFI.



