Интерес к добавочным почечным артериям, чаще всего отходящим от переднебоковой поверхности брюшной аорты или от подвздошных артерий, с клинической точки зрения во многом определяется возможной их связью с развитием и нарастанием артериальной гипертензии (АГ) [1–3]. Вопрос о связи добавочных почечных артерий с АГ остается крайне противоречивым и малоизученным. Добавочные почечные артерии до настоящего времени не являются признанным вариантом реноваскулярной АГ [4].
Предполагается, что более тонкие, чем основные, добавочные почечные артерии приводят к снижению кровоснабжения определенного участка почки с последующим развитием ишемии и повышением активности ренин-ангиотензин-альдостероновой системы (РААС), ведущей к развитию АГ [5].
Значимость РААС в развитии АГ доказана в многочисленных исследованиях [6, 7]. Начальным звеном РААС служит юкстагломерулярный аппарат, в котором происходит биосинтез ренина, высвобождаемого сперва в почечный, а затем в системный кровоток. Ренин оказывает влияние на ангиотензиноген. При расщеплении последнего образуется ангиотензин I, превращающийся в результате воздействия соответствующего фермента в ангиотензин II, который вызывает сужение артериол, выступая причиной повышения как систолического, так и диастолического компонентов артериального давления (АД). Непосредственное влияние ангиотензина II на кору надпочечников приводит к росту концентрации в крови кортизола и альдостерона [8].
Изучение функциональной активности РААС у пациентов с добавочными почечными артериями, визуализация которых стала возможной только в последние десятилетия, отмечено в единичных работах с весьма неоднозначными выводами. Наиболее интересными представляются результаты, свидетельствующие о возможной причинной роли множественных почечных артерий в нарушениях внутрипочечной гемодинамики с последующей гиперактивацией ренина и формированием АГ [3].
Вместе с тем в существующих исследованиях не содержится сравнительных данных об активности РААС в зависимости от количества и локализации добавочных почечных артерий, их сочетания с другими анатомическими особенностями органов мочевыводящей системы. Необходимость индивидуализированного подхода к выбору оптимальной тактики ведения молодых пациентов с АГ при наличии добавочных почечных артерий определила цель нашего исследования – изучение показателей ренина и альдостерона в плазме крови у этой категории больных.
МАТЕРИАЛ И МЕТОДЫ
Обследованы 40 пациентов (33 мужчины и 7 женщин) в возрастном диапазоне 18–35 лет (средний возраст 27,05±0,92 года) с АГ и добавочными почечными артериями, подписавшие информированное согласие на участие в исследовании. К критериям исключения относились отказ пациента от участия на любом этапе исследования, вторичная АГ (стеноз магистральных ренальных сосудов, заболевания почек, надпочечников, опухоли, системные заболевания соединительной ткани и др.), сахарный диабет, хроническая сердечная недостаточность, беременность.
Добавочные почечные артерии верифицировали методами мультиспиральной компьютерной томографии (МСКТ), выполненной по сосудистой программе, и ретроградной (трансфеморальной) аортографии. АГ устанавливали в соответствии с клиническими рекомендациями [9, 10].
Обобщение вариантной анатомии добавочных почечных артерий в случаях АГ представлено в табл. 1.
Добавочные почечные артерии у больных АГ отходили от латеральной части аорты и входили чаще всего в верхний полюс (60% случаев), реже в нижний полюс (32,5%), в единичных случаях (5%) одномоментно в оба полюса и в одном случае (2,5%) отмечена ранняя бифуркация.
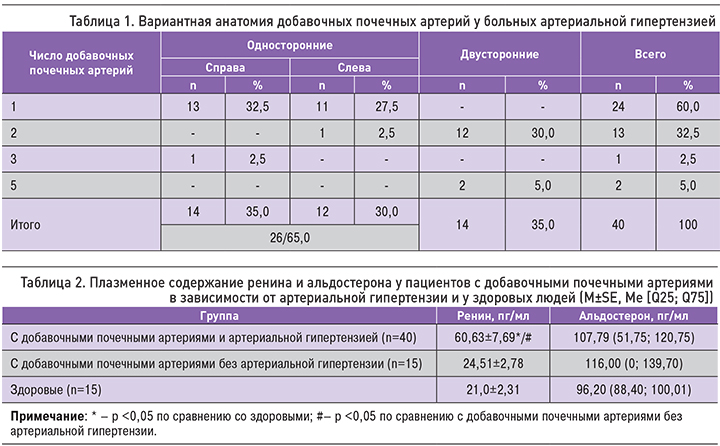
В случаях билатерального характера добавочных почечных артерий преобладала их верхнеполюсная локализация (78,57%), а при одностороннем отхождении – в равной степени верхне- и нижнеполюсная (соответственно 53,85 и 46,15%).
У 22 (55%) больных АГ добавочные почечные артерии были ассоциированы с другими анатомическими особенностями органов мочевыводящей системы: удвоением чашечно-лоханочного аппарата (52,5%), делением почки на доли по фетальному типу (2,5%).
Группы сравнения сформировали 15 пациентов с добавочными почечными артериями без АГ (12 мужчин и 3 женщины, средний возраст 26,27±1,14 года) и 15 здоровых людей (12 мужчин и 3 женщины, средний возраст 26,0±1,03 года). В группе с добавочными почечными артериями без АГ у 6 (40%) пациентов было диагностировано удвоение чашечно-лоханочного аппарата.
Проводили иммуноферментный анализ плазменных уровней ренина (BCM Diagnostic) и альдостерона (Aldosterone ELISA).
Статистическая обработка осуществлялась с помощью программы IBM SPSS Statistics (версия 21 для Windows). В случае нормального распределения выборки данные представлялись в виде среднего значения со стандартной ошибкой (M±SЕ), при отсутствии нормального распределения – в виде медианы и межквартильного размаха (Ме (Q25; Q75). Сравнение данных проводили с помощью однофакторного дисперсионного анализа с поправкой Бонферрони (при нормальном распределении), критериев Крускала–Уоллиса и Манна–Уитни (при отсутствии нормального распределения). Различия считались статистически значимыми при величине р <0,05.
РЕЗУЛЬТАТЫ
У больных АГ с добавочными почечными артериями плазменное содержание ренина было значительно выше, чем у пациентов с добавочными почечными артериями без АГ и у здоровых людей. Уровень альдостерона у пациентов сравниваемых групп оказался идентичным и соответствовал диапазону нормы (табл. 2).
Констатация повышенного плазменного уровня ренина может быть аргументом в пользу того, что формирование или нарастание АГ действительно связано с особенностями кровоснабжения почек, обусловленными наличием добавочных почечных артерий. В связи с этим важна информация о корреляции концентрации прямого ренина с активностью ренина плазмы. Более того, считается, что определение концентрации прямого ренина (в отличие от исследования активности ренина плазмы) характеризуется меньшей вариабельностью и большей восприимчивостью результатов, а полученное значение практически не зависит от уровня эндогенного ангиотензиногена [11].
Отсутствие активации РААС у пациентов с добавочными почечными артериями без АГ, по-видимому, можно объяснить сохранностью механизмов регуляции АД на системном уровне.
Вместе с тем пациенты с добавочными почечными артериями и АГ были гетерогенны по уровню ренина плазмы. Частота норморениновой формы АГ составила 20%, низкорениновой – 17,5%, а высокорениновой – 62,5%. Примечательно, что в когорте пациентов с так называемой эссенциальной АГ была отмечена иная структура встречаемости нормального, низкого и высокого ренинового статуса: 56, 32 и 12% соответственно [12]. Повышение уровня ренина плазмы у больных АГ с добавочными почечными артериями свидетельствует о возможной ишемии почки, приводящей к гипоксии ткани и оксидативному стрессу. В литературе имеются сведения о более частой регистрации высокорениновой гипертензии у молодых мужчин, в то время как с возрастом содержанию ренина плазмы присуща тенденция к уменьшению [8, 13]. Примечательно, что гиперрениновый и гипорениновый варианты АГ некоторыми исследователями не рассматриваются в качестве отдельных видов гипертензии, а квалифицируются как разные фазы течения болезни [14].
С другой стороны, стратификации больных АГ по уровню ренина позволяет определить дифференцированную тактику ведения. Доказано, что повышенная концентрация ренина при АГ ассоциирована с более высоким риском кардиоваскулярных последствий и развитием почечной недостаточности [8, 15, 16]. Обоснованы и селективные подходы к выбору медикаментозной терапии у высоко- и низкорениновых больных АГ [8].
Нами были исследованы уровни ренина и альдостерона у пациентов с АГ в зависимости от числа добавочных почечных артерий. Больные АГ были условно разделены на две группы: 1-я (n=24) c одной добавочной почечной артерией и 2-я (n=16) – с 2–5 добавочными почечными артериями (рис.).
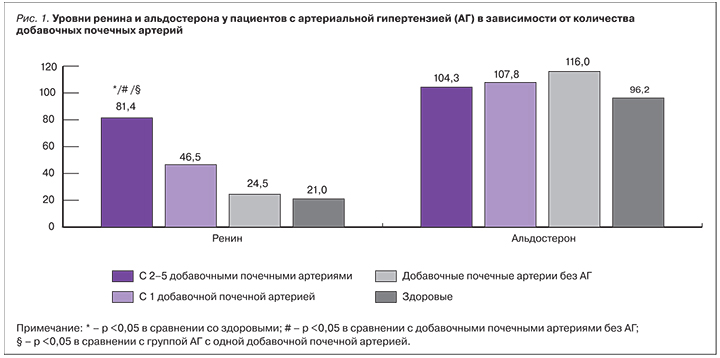
Оказалось, что уровень ренина плазмы у больных АГ с 2–5 добавочными почечными артериями был максимальным, статистически достоверно превышая таковой в группе АГ с одной добавочной почечной артерией (р=0,018), а также у пациентов с добавочными почечными артериями без АГ (р <0,0001) и у здоровых людей (р <0,0001). Полученные результаты подтверждают существующее мнение о том, что лица с множественными почечными артериями в большей степени подвержены развитию высокорениновой АГ [3]. Концентрация альдостерона при этом не зависела от числа добавочных почечных артерий и оценивалась как соответствующая контрольным величинам.
Был также проведен анализ показателей ренина и альдостерона с учетом локализации добавочных почечных артерий: верхнеполюсной (n=25) и нижнеполюсной (n=13). Несмотря на то что концентрация ренина в крови у больных АГ с верхне- и нижнеполюсной локализацией добавочных почечных артерий оценивалась как идентичная (63,28±11,41 и 54,44±9,28 пг/мл соответственно; р=1,000), у первых наблюдались более высокие его величины, превышающие таковые в группе добавочных почечных артерий без АГ (р=0,018) и у здоровых людей (р=0,008). Превышение концентрации ренина в случаях АГ с нижнеполюсной локализацией добавочных почечных артерий носило недостоверный характер. Уровень альдостерона у больных АГ не зависел от локализации добавочных почечных артерий: соответственно 106,88 (54,50; 119,95) и 108,70 (30,0; 126,85) пг/мл и не отличался от групп сравнения (р=0,793).
Более высокий уровень ренина у больных АГ с верхнеполюсной локализацией добавочных почечных артерий может быть объяснен с позиции обычно меньшего (до 2–3 раз) диаметра добавочных артерий, идущих к верхнему полюсу почки, по сравнению с диаметром нижнеполюсных добавочных артерий [17].
Показатели ренина плазмы в группе больных АГ с добавочными почечными артериями не зависели от наличия других анатомических особенностей органов мочевыводящей системы, например от деления почки на доли по фетальному типу, удвоения чашечно-лоханочного аппарата: 64,56±9,79 и 55,83±12,44 пг/мл соответственно в группе с указанными анатомическими особенностями органов мочевыводящей системы и без таковых (р=1,000). Однако уровень ренина у больных АГ с добавочными почечными артериями и другими анатомическими особенностями органов мочевыводящей системы характеризовался как достоверно повышенный по сравнению с группой добавочных почечных артерий без АГ (р=0,014) и со здоровыми людьми (р=0,006). Концентрация ренина у больных АГ с добавочными почечными артериями без других анатомических особенностей органов мочевыводящей системы существенно не отличалась от таковой в группе пациентов с добавочными почечными артериями без АГ (р=0,125) и от нормы (р=0,063). Уровень альдостерона у больных АГ не зависел от локализации добавочных почечных артерий: соответственно 103,44 (29,13; 115,25) и 113,75 (62,0; 153,36) пг/мл и не отличался от групп сравнения (р=0,542).
ЗАКЛЮЧЕНИЕ
Таким образом, у больных АГ с добавочными почечными артериями установлена достоверно более высокая концентрация ренина, выступающего в роли патогенетического звена формирования АГ. Гиперрениновый вариант АГ преобладал по частоте, тогда как два других – норморениновый и низкорениновый – в сумме составляли чуть более трети случаев. Максимально высокий уровень плазменного ренина отмечен у больных АГ с множественными добавочными почечными артериями и/или верхнеполюсной их локализацией, а также при сочетании с другими анатомическими особенностями органов мочевыводящей системы (деление почки на доли по фетальному типу, удвоение чашечно-лоханочного аппарата). Подобной зависимости для плазменного адьдостерона обнаружено не было. Вполне очевидно, что исследование ренинового статуса позволяет не только выделить патофизиологический механизм повышения АД, но и определить более успешную стратегию лечения, в частности выбор антигипертензивной терапии у больных данной категории.



