В последние годы отмечается возрастание числа заболеваний сердца и сосудов среди лиц более молодого возраста: 20–30% впервые выявленных случаев острого нарушения коронарного кровообращения приходятся на пациентов моложе 50 лет. Одним из наиболее тяжелых проявлений кардиоваскулярной патологии и ишемической болезни сердца (ИБС) по сей день является острый инфаркт миокарда (ИМ).
За последние годы взгляды на этиологию и патогенез этого заболевания изменились, в диагностический процесс внедрены новые технологии, накоплены новые данные, касающиеся клинического течения заболевания, результатов лечения, получения длительных ремиссий у больных ИБС, перенесенным инфарктом миокарда. Так, введение в практику такого теста, как высокочувствительный тропонин I, повысило выявляемость ИМ у больных острым коронарным синдромом без подъема сегмента ST [1]. И все же, несмотря на стремительное развитие медицины, летальность от острого ИМ остается высокой: госпитальная летальность колеблется от 4 до 15%, на догоспитальном этапе погибают 45–70% пациентов с острыми формами ИБС, в том числе из-за острого ИМ.
Под ИМ понимается одна из форм ИБС, протекающая с развитием некроза кардиомиоцитов из-за нарушения кровоснабжения сердечной мышцы [2, 3]. Основная причина его развития – это разрыв атеросклеротической бляшки [4]. Клинические проявления ИМ многообразны: от типичного болевого синдрома до атипичных проявлений. Безусловно, такая симптоматика затрудняет диагностику заболевания [5].
Пересмотр диагностических подходов привел к изменению общепринятой классификации ИМ и введению такого понятия, как «повреждение миокарда», что отражено в 4 Универсальном определении инфаркта миокарда.
Диагноз ИМ основывается на трех постулатах: клинической картине, данных электрокардиографии (ЭКГ) и изменении в лабораторных анализах. Патогномоничным признаком того, что в миокарде произошел некроз, служит повышение в крови специфических маркеров [2]. Ранее исследовались креатинфосфокиназа и ее миокардиальная фракция, лактатдегидрогеназа, трансаминазы, но они имеют низкую специфичность и могут возрастать при различных заболеваниях и состояниях [4, 6].
В настоящее время в первые часы заболевания определяют тропонины, которые обладают следующими особенностями: уникальной аминокислотной последовательностью, высокой внутриклеточной концентрацией и длительным высвобождением из поврежденного миокарда [2]. Все это обеспечивает высокую чувствительность и специфичность анализа, что делает определение тропонинов более ценным в диагностике повреждений миокарда. В последнее время широко используют определение Д-димера в крови. Многочисленными исследованиями было показано, что его повышенный уровень – независимый предиктор развития ИМ или внезапной коронарной смерти [7–9].
Определенно: ценность лабораторных анализов возрастает в тех случаях, когда затруднена ЭКГ-диагностика ИМ, например, при повторных инфарктах, мерцательной аритмии, искусственном водителе ритма и т.д. [10]. В этих ситуациях может помочь определение маркеров воспаления и некоторых показателей системы гемостаза [11]. Целью нашего исследования, продиктованного необходимостью повышения эффективности диагностики ИМ, стала оценка маркеров некроза миокарда в зависимости от изменений сегмента ST, наличия осложнений и сопутствующей патологии у больных острым ИМ.
МАТЕРИАЛ И МЕТОДЫ
Нами были просмотрены, отобраны и обработаны истории болезней 71 пациента, которые в 2017–2018 гг. находились на стационарном лечении в кардиологическом отделении Республиканского кардиологического диспансера Минздрава Чувашской Республики с диагнозом «острый ИМ». Диагноз был установлен на основании клинических данных, результатов биохимических маркеров некроза миокарда и по заключению ЭКГ. Среди пациентов были 36 мужчин и 35 женщин, средний возраст которых составил 63±2,1 и 71,3±1,55 лет соответственно. Все пациенты были разделены на две группы: группа с подъемом сегмента ST (n=32; 18 мужчин, 14 женщин) и группа без подъема сегмента ST (n=39; 18 мужчин, 21 женщина).
Нами учитывались следующие данные лабораторных и инструментальных методов исследования: ЭКГ (локализация поражения, наличие зубца Q, изменение сегмента ST), анализы крови (количественное определение тропонина I и Д-димера), наличие сопутствующих заболеваний и осложнений.
Концентрацию тропонина I (cTnI) определяли иммуноферментным методом. Моноклональные анти-cTnI антитела, конъюгированные со щелочной фосфатазой, добавляли в реакционную пробирку вместе с содержащим сурфактант буферным раствором и исследуемой пробой. После непродолжительной инкубации добавляли парамагнитные частицы, покрытые моноклональными анти-cTnI антителами. После инкубации в реакционной пробирке материалы помещали в магнитное поле. После этого в пробирку добавляли хемилюминесцентный субстрат Lumi-Phos 530, а излучение, генерируемое в процессе реакции, измерялось люминометром. Результаты анализа пациента определялись автоматически. Количество анализируемого вещества в пробе определяли на основе измерения свечения с использованием калибровочных данных и применением математической корректировки. Концентрация тропонина, имеющая диагностическую значимость для идентификации ИМ, составляет выше 0,05 нг/мл.
Д-димер определяли в плазме крови человека с помощью реагента INNOVANCE® D-Dimer путем турбидиметрического иммуноанализа на коагулометре. Суть метода заключается в том, что частицы полистирола, ковалентно покрытые моноклональными антителами (8D3)14, при смешении с образцами, содержащими Д-димер, агрегируются. Агрегация определялась турбидиметрически через повышение мутности среды, а значит, и увеличения оптической плотности реагента, что выражалось количественно. Концентрация Д-димера, имеющая диагностическую значимость, составляет выше 0,50 мкг/мл.
Статистическая обработка полученных данных проведена методом вариационной статистики. Для выявления статистической значимости различий использовался критерий Стьюдента. Различия считались статистически значимыми при р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В 2017 г. в кардиологическом отделении на стационарном лечении находился 71 пациент с диагнозом «острый ИМ»: 36 мужчин (51%) и 35 женщин (49%). Из них у 45% (n=32) на ЭКГ выявлялся подъем сегмента ST, у 55% (n=39) подъем сегмента не наблюдался. Рецидив заболевания был диагностирован у 9 человек, кардиогенный шок выявлялся у 10 пациентов, отек легких – у 6, заболевания молочной железы – у 3 женщин. Данные по локализации ИМ представлены в таблице.
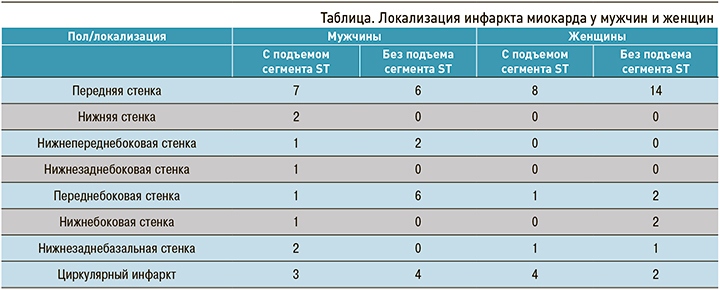
Чаще всего наблюдался острый ИМ передней стенки левого желудочка (49%), при этом у женщин почти в 2 раза чаще, чем у мужчин. Циркулярный инфаркт диагностировался примерно с одинаковой частотой как у мужчин, так и у женщин.
У лиц женского пола острый ИМ встречался в более позднем возрасте (от 54 до 86 лет), чем у мужчин (от 37 до 82 лет), что, вероятнее всего, связано с гормональными изменениями в постменопаузальном периоде [2].
У 18 мужчин и у 21 женщины с ИМ без подъема сегмента ST выявлено, что средняя концентрация тропонина I составила 4,99±4,2 и 5,19±3,1 нг/мл соответственно (р <0,05). При этом максимальные значения тропонина достигали уровня 75,89 и 63,28 нг/мл (при норме 0,03–0,05 нг/мл). Среднее значение Д-димера у мужчин составило 1,79±0,38 мкг/мл, у женщин – 3,4±0,96 мкг/мл, с наибольшими значениями 5,65 и 14,86 мкг/мл соответственно (при норме 0–0,5 мкг/мл).
На фоне подъема сегмента ST средняя концентрация тропонина I составила у мужчин 16,97±5,6 нг/мл, у женщин – 24,9±9,15 нг/мл. Максимальные значения достигали 99 нг/мл. Д-димер также был повышен и составил у лиц мужского пола 2,65±1,05 мкг/мл, у лиц женского пола – 4,77±2,4 мкг/мл с максимальным увеличением до 18,17 и 35,5 мкг/мл соответственно. Большее увеличение маркеров миокардиального некроза при ИМ с подъемом сегмента ST связано с трансмуральным поражением миокарда.
Максимальные значения тропонина I в плазме определялись у мужчин и женщин обеих групп при циркулярном остром ИМ. При этой же форме заболевания, а также при локализации участка некроза на передней стенке левого желудочка наблюдалось наибольшее увеличение Д-димера.
Интересно, что повышение уровня Д-димера было связано не только с ИМ, но и наличием сопутствующей патологии, осложнениями ИМ и недавними оперативными вмешательствами. Так, при ИМ без осложнений и сопутствующей патологии средняя концентрация Д-димера составляла 1,29±0,22 мкг/мл, при наличии осложнений ИМ – 2,22±0,43 мкг/мл, при сопутствующей патологии – 3,65±1,43 мкг/мл. Самое большее увеличение Д-димера наблюдалось у пациентов после недавних оперативных вмешательств (6,59±3,32 мкг/мл). Это связано в первую очередь с тем, что Д-димер образуется в процессе активации гемокоагуляции вследствие повреждения эндотелиальной выстилки не только сосудов сердца, но и всего организма, и таким образом, чем больше повреждение, тем выше его уровень.
Содержание тропонина при этом коррелировало с наличием осложнений ИМ и рецидива (21,12±7,55 и 15,4±7,9 нг/мл соответственно), что полностью доказывает связь уровня тропонина и масштаба повреждения сердца.
ЗАКЛЮЧЕНИЕ
Таким образом, у мужчин и женщин, имеющих острый ИМ с подъемом сегмента ST, концентрация тропонина I и Д-димера во много раз превышает его уровни у пациентов без подъема сегмента ST. При этом увеличение маркеров некроза напрямую зависит от локализации инфаркта, наличия осложнений, рецидива заболевания и сопутствующей патологии. Острый ИМ у женщин встречался в более позднем возрасте, чем у мужчин. При этом нужно отметить, что только у мужчин был диагностирован ИМ в возрасте моложе 50 лет.
Одним из разрабатываемых в настоящее время направлений оптимизации диагностики инфаркта миокарда является внедрение теста на высокочувствительный тропонин [12, 13]. При внедрении таких тестов в широкую клиническую практику в российских медицинских учреждениях возникает множество вопросов, связанных с частотой их применения у больных, сложностями интерпретации результатов и высокой себестоимостью тестов. Поэтому параллельное использование таких тестов, как D-димер, нахождение корреляций его изменений с данными ЭКГ и клиническими проявлениями может повысить эффективность уже используемых лабораторных маркеров.



