Несмотря на значительные достижения в области современной ангионеврологии, цереброваскулярные заболевания по-прежнему остаются основной причиной смертности и стойкой инвалидизации в мире. На сегодняшний день инсульт относится к важнейшим медико-социальным проблемам, что подтверждается эпидемиологическими данными: ежегодно в мире острое нарушение мозгового кровообращения (ОНМК) переносит более 6 млн человек, в России частота заболеваемости ОНМК колеблется от 460 до 560 случаев на 100 тыс. человек [1]. Согласно многолетним статистическим данным, исключительно широкой распространенностью характеризуется ишемический инсульт (ИИ) – одна из наиболее тяжелых форм цереброваскулярных расстройств. Среди всех церебральных сосудистых катастроф на его долю приходится 70–85% случаев [2]. Наблюдаемая в последние десятилетия устойчивая тенденция к «омоложению» ИИ и его развитию в трудоспособном возрасте усиливает социально-экономическую значимость этой проблемы [3].
Несмотря на все более активное внедрение в клиническую практику современных методов нейровизуализации (КТ и МРТ высокого разрешения, перфузионно-взвешенная МРТ, диффузионно-взвешенное МРТ, функциональное МРТ, МР-трактография и др.), позволяющих оценить патоморфологические зоны головного мозга, определение причины развития инсульта по-прежнему затруднительно, и зачастую механизм его инициации остается неясным. При этом в острейшем периоде, особенно при невыраженных симптомах, дифференциальный диагноз между ИИ и другими неврологическими заболеваниями представляет собой особую сложность, что негативно сказывается на тактике ведения пациентов, оптимизации их лечения и профилактики. Все вышесказанное определяет необходимость поиска новых экспресс-диагностических тестов для выявления церебральной ишемии и дифференциации различных ее вариантов.
К настоящему времени одним из приоритетных направлений исследований в области неврологии является использование биологических маркеров плазмы крови. В отечественной и зарубежной литературе этому вопросу посвящено множество исследований, но большинство результатов противоречиво и зачастую не подтверждаются в повторных исследованиях. На сегодня существует достаточно много различных показателей, рассматриваемых в качестве биомаркеров, но лишь немногие из них продемонстрировали практическое значение в диагностике и прогнозировании дальнейшего течения инсульта [4–6]. Среди них выделяются ферменты (фосфолипаза А2, связанная с липопротеинами, матриксная металлопротеиназа-9), нейроспецифические белки (основной белок миелина, мозговой нейротрофический фактор, нейрон-специфическая енолаза), острофазные белки (С-реактивный белок), ростовые и трофические факторы, а также антитела к ДНК1 [7, 8].
Современные представления о гетерогенности и мультифакториальности ИИ предусматривают детальное изучение всех звеньев патогенеза, способствующих развитию ОНМК. По этой причине один биомаркер, возможно, не может в достаточной степени отразить лежащую в основе развития инсульта патологию. Так, многочисленные литературные данные, описывающие изменения гемостаза и гемореологии в остром периоде ИИ, свидетельствуют о стойкой гемостатической активации, повышении уровня маркеров тромбообразования, усилении спонтанной агрегации тромбоцитов, повышении экспрессии маркеров эндотелиальной дисфункции. Кроме этого, установлено, что одной из главных причин развития как острого, так и отсроченного ишемического повреждения вещества мозга являются иммунологические изменения в виде активации микроглии, увеличения синтеза стрессовых белков, развития реакции воспаления [9]. Поскольку повышение концентрации провоспалительных медиаторов и маркеров эндотелиальной дисфункции выступает проявлением единого патологического процесса, в основе которого лежит сосудистое воспаление, тесно сопряженное с активацией системы гемостаза и повышенным риском тромбообразования [10], в нашем исследовании проводится их совместное изучение для выявления большей диагностической чувствительности.
Многолетние исследования в области патогенеза нарушения мозгового кровообращения позволили констатировать, что поражение мозга при инсульте – следствие процессов, связанных с ишемией, реперфузией и взаимодействием форменных элементов крови, плазмы, эндотелия, нейронов, глии и сосудистой стенки [11]. Эндогенными факторами, или «стерильными», т.е. неинфекционными стимулами, активирующими микроглию, служат молекулы, образующиеся в ходе нейродеструктивного процесса. По современным представлениям, развивающееся в головном мозге «стерильное» (асептическое) воспаление относится к факторам, в большой мере определяющим возможность разрешения или усугубления инсульта [12].
Так, процесс воспаления в центральной нервной системе (ЦНС) имеет как отрицательные, так и положительные последствия. Иммунные клетки, продуцируя ряд нейротоксических факторов (активные формы кислорода, металлопротеазы, интерлейкин-1β, оксид азота, фактор некроза опухолей-α) и обеспечивая рекрутирование циркулирующих лейкоцитов, также вовлечены в запуск и поддержание постишемического воспаления, вызывающего вторичные повреждения и гибель нейронов [13]. С другой стороны, воспалительная реакция при нейродегенерации связана с миграцией в очаг повреждения в первую очередь микроглии – специализированных иммунных клеток центральной нервной системы, участвующих в гомеостазе внеклеточной среды нейронов и действующих как «очистители» от поврежденных и погибших клеток в случае инфекции, воспаления, травмы или ишемии. Параллельно с этим происходит активация и миграция моноцитов/макрофагов и лимфоцитов крови к очагу повреждения через дефекты клеточных мембран эндотелия в составе гематоэнцефалического барьера (ГЭБ) в ответ на выработку хемоаттрактантов, генерируемых астроцитами, нейронами и микроглией [14, 15]. В данном случае активация иммунных клеток в ЦНС необходима для удаления патогенов, остатков мертвых клеток и клеточного дебриса, а также запуска процессов репарации при повреждении [16, 17]. Тем не менее избыточная выраженность или персистенция воспалительного процесса оказывает негативный эффект на восстановление поврежденной нервной ткани [18].
Дальнейшая постишемическая нейровоспалительная реакция приводит к динамическим изменениям в проницаемости ГЭБ и, как следствие, отеку мозга и гибели нейронов [19]. Поэтому именно детальное изучение центральных молекулярных механизмов, лежащих в основе деградации и перераспределения различных белковых компонентов ГЭБ в соответствии с типом, тяжестью и продолжительностью мозговых ишемических инсультов, дает ключ к пониманию основы гемостаза нормальной функции мозга в виде передачи сигналов между различными клетками нейронального и глиального типа, а также сосудистыми компартментами. И наоборот, дисфункциональная передача сигналов внутри сосудисто-нервного блока способствует развитию болезни.
Цель исследования – изучение маркеров сосудистого воспаления у больных в острейшей фазе ишемических нарушений мозгового кровообращения для ранней диагностики и прогноза течения заболевания.
МАТЕРИАЛ И МЕТОДЫ
Клиническая часть работы выполнялась на кафедре неврологии ФДПО Российского национального исследовательского медицинского университета им. Н.И. Пирогова на базе Городской клинической больницы № 13 г. Москвы в период с 2015 по 2019 г.
В исследование было включено 108 человек. Две основные группы составили 78 пациентов (38 мужчин (49%) и 40 женщин (51%), средний возраст 62 года) с ОНМК, проходивших лечение в нейрореанимационном отделении Городской клинической больницы № 13, чье состояние анализировалось в первые 24 ч от начала развития заболевания:
- 39 пациентов с впервые развившимся ИИ (23 мужчины (59%) и 16 женщин (41%), средний возраст 68 лет);
- 39 с транзиторной ишемической атакой в острейшей фазе (15 мужчин (38%) и 24 женщины (62%), средний возраст 62 года).
В группу контроля вошли 30 практически здоровых донора-добровольца в возрасте от 18–35 лет, из них 15 (50%) мужчин и 15 (50%) женщин.
Тяжесть состояния больных с диагнозом «инфаркт головного мозга» оценивалась в соответствии со шкалой тяжести инсульта Национального института здоровья США (National Institutes of Health Stroke Scale – NIHSS). Всем больным наряду с клиническим обследованием проводили оценку маркеров сосудистого воспаления ИФА-методом с использованием прибора Multiskan (D-димер, нейтрофильный желатиназа-ассоциированный липокалин (NGAL), ИЛ-1, фактор некроза опухоли α (ФНО-α)) и спектрофотометрическим методом с использованием реактивов фирмы РЕНАМ (плазминоген, антиплазмин, протеин С). Статистическая обработка проводилась с помощью программы STATISTICA (StatSoft, USA), версия 6.
Критериями невключения в исследование были геморрагический инсульт, подтвержденный методами нейровизуализации (КТ или МРТ головного мозга); инфаркт головного мозга с геморрагическим пропитыванием, ОНМК в анамнезе; инфаркт миокарда в анамнезе давностью менее 1 года; фибрилляция предсердий; эпилепсия; системные заболевания соединительной ткани; наличие в анамнезе онкологических заболеваний, иммунодепрессивных состояний, туберкулеза, алкогольной или наркотической зависимости; острые инфекционные заболевания (грипп, ОРВИ и др.), менее чем за 4 нед до исследования; воспалительные заболевания суставов, внутренних органов; интоксикации; противопоказания для проведения КТ и МРТ головного мозга; участие в других клинических исследованиях.
Всем больным проводилась терапия, не включающая препараты, влияющие на сосудисто-тромбоцитарный гемостаз.
Забор крови у больных, включенных в исследование (первые 24 ч от начала заболевания), а также у лиц контрольной группы производили утром натощак (спустя 12–14 ч после приема пищи) из кубитальной вены. Плазму отделяли путем центрифугирования при 2500 об./мин в течение 15 мин не позднее 2 ч после забора крови. Кровь забирали в силиконовые пробирки, содержащие стабилизатор, в качестве которого использовались 3,8% раствор цитрата натрия и Li-гепарина, и немедленно перемешивали. Соотношение крови и стабилизатора составляло 9,0:1,0. Исследования проводили либо непосредственно из свежеприготовленной плазмы, либо замораживали и хранили при температуре –52 °С.
Полученные результаты представлены в виде медианы и интерквартильных размахов (Ме [Q1; Q3]). В качестве критерия достоверности использовали статистический критерий Манна–Уитни для двух несвязанных групп, Краскелла–Уоллиса ANOVA для трех и более несвязанных групп, а также корреляционный критерий Тау Кендалла. За достоверные принимались значения при р <0,05. Анализ сопряженности был проведен с применением критерия χ2 Пирсона.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При выполнении нейровизуализационного исследования подтверждался ишемический характер инсульта, и наряду с методами лабораторных, инструментальных, клинических исследований проводилось определение патогенетического подтипа инсульта в соответствие с критериями TOAST. По TOAST атеротромботический вариант был диагностирован у всех 39 пациентов с ИИ. На основании шкалы NIHSS среди них классифицировано 25 пациентов с неврологическими нарушениями легкой степени (3–8 баллов), 11 – средней тяжести (9–12 баллов), 3 – крайней степени тяжести (13–15 баллов).
Синдромологический анализ наших наблюдений обнаружил, что в двух основных группах исследования в 68% случаев (53 человек) в процесс был вовлечен каротидный бассейн, в 32% (25 человек) – вертебробазилярный. При этом в группе больных ИИ каротидный бассейн вовлекался в патологический процесс в 79% случаев, вертебробазилярный – в 21%; в группе больных с транзиторной ишемической атакой (ТИА) регистрация по данной локализации процесса составила 56 и 44% соответственно.
Был проведен анализ анамнестических данных исследуемых групп пациентов. В результате было выявлено значительное количество коморбидных состояний, свидетельствующих о системном поражении сердечно-сосудистой системы. Наиболее часто встречающимися фоновыми заболеваниями были артериальная гипертензия 3 степени (92%) и атеросклероз брахиоцефальных артерий различной степени выраженности (65%). Сопутствующими заболеваниями являлись ИБС (46%), ИБС: постинфарктный кардиосклероз (4%).
При определении содержания D-димера его уровень у пациентов с острым ИИ был достоверно выше по сравнению с группой ТИА (Me=130 [LQ=30; UQ=550], Me=50 [LQ=23; UQ=128], p=0,02) и по сравнению с группой контроля (Me=130 [LQ=30; UQ=550], Me=50 [LQ=16; UQ=80], p=0,04); это косвенно свидетельствует о нарушении функции эндотелия, окислительном стрессе и воспалении. Достоверного различия величин D-димера между группой с ТИА и группой контроля не выявлено (Me=50 [LQ=23; UQ=128], Me=50 [LQ=16; UQ=80], p=0,5) (рис. 1).
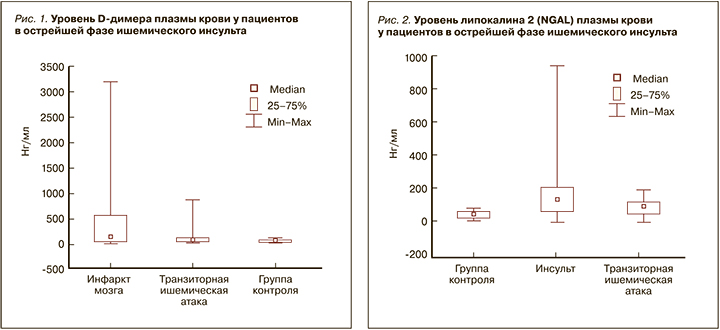
При определении содержания NGAL его уровень был достоверно выше у пациентов с острым ИИ по сравнению с группой ТИА (Me=135 [LQ=70; UQ=220], Me=110 [LQ=68; UQ=145], p=0,04) (рис. 2). Уровень NGAL в обеих группах исследования был выше референсных его значений (37–106 нг/мл), что отражает активацию нейтрофилов, прогрессирование окислительного стресса и наличие иммунного воспаления.
Показатели маркеров интерлейкина-1 (ИЛ-1), ФНО-α, плазминогена, антиплазмина, протеина С были сопоставимы с данными контрольной группы (p >0,05), что, по-видимому, свидетельствует об отсроченности маркирования процесса воспаления, а не об отсутствии самой сосудистой воспалительной реакции.
ЗАКЛЮЧЕНИЕ
Таким образом, совокупность полученных в работе результатов свидетельствует о достоверном повышении уровня D-димера и NGAL плазмы крови у пациентов с ИИ по сравнению с группой ТИА. Указанные показатели могут рассматриваться в качестве диагностических маркеров ранней фазы острого нарушения мозгового кровообращения у лиц с КТ-негативными данными инфаркта мозга в первые 48 ч, а также применяться для дифференциальной диагностики ТИА и инфаркта мозга.



