ВВЕДЕНИЕ
Ишемический инсульт (ИИ) – медико-социальное и экономически значимое заболевание. Высокая смертность, долгосрочная инвалидность пациентов после ИИ и связанные с ней значимые экономические потери [1, 2] делают разработку новых патогенетически обоснованных алгоритмов лечения этого заболевания крупной научной и практически значимой проблемой. Для ее решения требуются новые научные знания о механизмах регуляции процессов повреждения и восстановления нервной ткани при ИИ.
При развитии ИИ и на его отдаленных этапах показано нарастание масштаба апоптоза нейронов и глиальных элементов в головном мозге [3, 4]. Апоптоз – это сложный процесс регулируемой гибели клетки [5]. Значимым внешним стимулом индукции апоптоза может быть взаимодействие лигандов и рецепторов смерти суперсемейства фактора некроза опухоли (TFN). Их мембранные формы выявлены на поверхности нейронов [6], а содержание растворимых форм изменяется в периферической крови после повреждений нервной ткани [7–9]. Снижение интенсивности процессов апоптоза нейронов и блокирование его сигнальных путей рассматривается как перспективное направление нейропротекции. Однако активация рецепторов смерти может приводить к широкому спектру биологических процессов, обеспечивающих еще и пластичность нервной ткани. Среди них пролиферация и дифференцировка нейронов, спраутинг и прунинг их отростков [10–13].
Цель исследования – выявить роль регулирующих апоптоз лиганд-рецепторных соотношений систем Fas и TFN-α в формировании клинических проявлений ИИ.
МАТЕРИАЛ И МЕТОДЫ
Проведено клиническое проспективное контролируемое исследование.
В исследование включались (критерии включения) давшие добровольное информированное согласие на участие в нем пациенты с впервые развившимся ИИ в бассейне левой (ЛСМА) или правой средней мозговой артерии (ПСМА), установленным клинически, подтвержденным при помощи методов нейровизуализации (магнитно-резонансная томография в Т-1, Т-2, DVI-режимах, компьютерная томография) или патологоанатомически.
В исследование не включались пациенты (критерии невключения) с геморрагическим инсультом, повторным ИИ, наличием черепно-мозговых травм, онкологических и аутоиммунных заболеваний в анамнезе, аллергических, воспалительных реакций, не связанных с ИИ, и тяжелой соматической патологии в стадии декомпенсации на момент исследования. Критериями исключения служили проведение реканализационной терапии, отказ пациента от участия в исследовании после подписания информированного согласия на любом этапе, геморрагическая трансформация ИИ, развитие инфекционных и аллергических осложнений в период пребывания в стационаре, отсутствие верификации диагноза ИИ.
Критериями включения в группу контроля были возраст, сопоставимый с основной группой исследования, отсутствие в анамнезе острых нарушений мозгового кровообращения и черепно-мозговых травм, онкологических и аутоиммунных заболеваний, аллергических реакций на момент исследования, информированное добровольное согласие.
Участие в исследовании не изменяло плана диагностических и лечебных мероприятий: все пациенты получали объем медицинской помощи в соответствии со стандартом медицинской помощи больным с инсультом (при оказании специализированной помощи). Исследование соответствовало требованиям Хельсинской декларации Всемирной медицинской ассоциации (2000) и было одобрено Межвузовским комитетом по этике (выписка из протокола заседания от 26.09.2019 № 08-19).
Всего было обследовано 948 пациентов, поступивших по каналу скорой медицинской помощи в неврологический стационар и отделение реанимации Городских клинических больниц № 6 и № 36 (г. Москва), из них вышеуказанным критериям соответствовали 155 человек (74 мужчины и 81 женщина, средний возраст 64±10 лет).
Для объективизации оценки неврологического дефекта пациентов с ИИ и возможности последующей статистической обработки данных использовалась стандартная международная Шкала инсульта Национального института здоровья (NIHSS). При выполнении лабораторного исследования периферической крови 155 больных на 1, 7 и 21-е сутки после ИИ в их крови определялось содержание растворимых рецептора и лиганда Fas (sFas, sFasL), TFN-α и его растворимого рецептора 1 (sTNF-R1), интерлейкина 6 (ИЛ-6) методом иммуноферментного анализа, а также выполнялось фенотипирование субпопуляций CD3+ и CD3CD95 (Fas) позитивных лимфоцитов методом проточной цитофлюорометрии. В группе контроля (28 человек, из них 13 мужчин и 15 женщин, средний возраст 63±8,4 лет) пробы крови брались однократно.
К ограничениям представленных данных можно отнести следующие обстоятельства: все пациенты, включенные в исследование, получали объем медицинской помощи в соответствии со стандартом медицинской помощи больным с инсультом (при оказании специализированной помощи), что не учитывалось при исследовании (за исключением проведения реканализационной терапии, которая была критерием исключения). Также не учитывались факт, продолжительность и характеристики интенсивной терапии.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В остром периоде ИИ во все сроки исследования происходило достоверное увеличение концентрации растворимых регулирующих апоптоз факторов систем Fas и TNF-α (за исключением sTNF-R1) по сравнению с контрольными показателями (р <0,01) (табл. 1).
С течением времени для растворимых эффекторов системы Fas было характерно прогредиентное нарастание вплоть до завершения острого периода ИИ (21-е сутки исследования), а для эффекторов системы TNF-α – более сложная разнонаправленная динамика. При этом все указанные параметры (за исключением sTNF-R1) в острейшем периоде ИИ (1-е сутки исследования) отражали тяжесть неврологического дефекта (табл. 2).

Сходный результат был получен при ретроспективной оценке, когда выполнялся корреляционный анализ между показателями концентраций регулирующих апоптоз систем Fas и TNF-α в острейшем периоде и выраженностью неврологического (в баллах по шкале NIHSS) и функционального дефекта (по шкалам Бартел и Рэнкина) в исходе острого периода ИИ. Наиболее высокие коэффициенты корреляции были характерны для показателей соотношения концентраций лигандов и рецепторов. При этом максимальной прогностической значимостью обладало отношение концентраций sFasL/sFas (r=0,675, p <0,01). При графическом отображении зависимости величины этого показателя и выраженности неврологического дефекта в исходе ИИ отмечалось разделение пациентов на две группы (рис. 1). Так, соотношение sFasL к sFas принимало значения менее 2,22±0,60, которые достоверно не отличались от контроля, при относительно низком уровне неврологического дефекта на 21-е сутки (NIHSS ≤5). В отличие от этого для пациентов с уровнем неврологического дефекта в исходе острого периода ИИ более 5 баллов по NIHSS отношение sFasL/sFas принимало значения 3,71±0,60, которые достоверно отличались и от значений контрольной группы (p <0,01) и показателей в группе с NIHSS ≤5 (p <0,01).
Учитывая, что функциональные ограничения пациента при неврологическом дефекте менее 5 баллов по NIHSS слабо выражены или полностью отсутствуют, на основании вышеприведенных результатов было принято решение о выделении в основной группе исследования двух подгрупп пациентов. Подгруппе пациентов, чьи данные распределились в первый кластер (NIHSS на 21-е сутки ≤5), присвоили название «подгруппа с благоприятным исходом ИИ», второй (NIHSS на 21-е сутки >5) – «подгруппа с неблагоприятным исходом ИИ». Выделение вышеуказанных подгрупп также было обосновано при сравнении р-уровней отличий между подгруппами с благоприятным и неблагоприятным исходом острого периода ИИ с разным граничным уровнем неврологического дефекта (рис. 2).

Из вышепредставленного следует, что отношение концентраций sFasL/sFas в настоящей работе служит ключевым прогностическим параметром функционального исхода острого периода ИИ. Сочетанное повышение концентрации растворимых регулирующих апоптоз лигандов в периферической крови в острейшем периоде ИИ, вероятно, связано с воспалительной реакцией в ответ на критическое падение уровня кислорода и субстратного обеспечения нервной ткани головного мозга. Оно тем сильнее, чем больше объем ишемического повреждения нервной ткани, который определяет тяжесть клинических неврологических проявлений ИИ. Так, в острейшем периоде ИИ получены достоверные корреляции между тяжестью неврологического дефекта в баллах NIHSS и величиной лейкоцитоза (r=0,365, p <0,01), лимфоцитоза (r=0,295, p<0,01), концентрацией ИЛ-6 (r=0,452, p <0,01). При уровне лейкоцитов выше 11×109/л летальность составляла 50%. Показатели системного воспалительного ответа, в свою очередь, прямо достоверно коррелировали с концентрациями sFasL и TNF-α (p <0,01).
Таким образом, основной вклад регулирующих апоптоз эффекторов систем Fas и TNF-α в патогенез острейшего периода ИИ (1–3-е сутки после манифестации ИИ) в большей мере определяется их вкладом в инициацию и развитие воспалительного ответа на ишемическое повреждение ткани головного мозга.
Считается, что реализуемый нейронами головного мозга вариант клеточной гибели при церебральной ишемии зависит от достаточности их энергообеспечения [14]. При ИИ формируется градиент дефицита кровотока и соответственно уровня кислородного и субстратного обеспечения нервной ткани. Поэтому формируется так называемый некрозапоптозный континуум [15]. Это объясняет одновременное увеличение в периферической крови маркеров воспаления и апоптоза, полученное в нашем исследовании.
Видимо, некорректно делать выводы о том, какой из рассматриваемых процессов имеет большую значимость в развитии острейшего периода ИИ в целом, однако же допустимо говорить об этом применительно к конкретному участку мозговой ткани и в определенный момент времени. В участках ткани с низким энергетическим обеспечением будут преобладать воспалительные явления, с достаточным – апоптотической гибели клеток (рис. 3).
С течением времени прослеживалось уменьшение силы и достоверности корреляционных связей между концентрациями лигандов систем Fas и TNF-α (на 1-е сутки r=0,366, p<0,01; на 7-е сутки r=0,196, p<0,05; на 21-е сутки r=-0,093, p >0,01). Это может свидетельствовать о расхождении направлений биологических эффектов sFasL и TNF-α.
При изучении динамики концентраций указанных биологически активных веществ (БАВ) в периферической крови также наблюдалось их расхождение. К 7-м суткам исследования концентрация TNF-α достоверно снижалась (p <0,05) и далее оставалась без динамики. Она продолжала отражать тяжесть неврологического дефекта (r=0,491, p <0,01), оказывать влияние на темп восстановления (r=0,493, p <0,01), достоверно коррелировала с концентрацией ИЛ-6 (r=0,318, p <0,01), лимфоцитозом (r=0,301, p <0,01). Концентрация TNF-α переставала коррелировать с уровнем лейкоцитов (r=0,014, p >0,01), что можно рассматривать как причину или следствие изменения характеристик воспалительного ответа.
Динамика концентрации sFasL была противоположной: на 7-е сутки наблюдалось достоверное увеличение в общей группе пациентов с ИИ (р <0,01), которое определяла подгруппа неблагоприятного исхода заболевания (р <0,01). Концентрация sFasL отражала тяжесть неврологического дефекта (r=0,491, p <0,01), темп восстановления (r=0,267, p <0,05), величину лимфоцитоза (r=0,411, p <0,01), концентрацию ИЛ-6 (r=0,695, p <0,01). Необходимо отметить, что уровень нейтрофилов к этому сроку нормализовался до контрольных значений. Однако при этом концентрации ИЛ-6, TNF-α, sFasL оставались выше контрольных значений (р <0,01).
Существенным фактором пролонгации гуморального провоспалительного ответа и высоких концентраций регулирующих воспаление и апоптоз факторов в периферической крови у пациентов с острым ИИ служит специфический аутоагрессивный иммуногенный ответ. Его может инициировать нарушение проницаемости гематоэнцефалического барьера (ГЭБ) при развитии ИИ [16]. После пика специфического иммуногенного ответа большинство антигенспецифических Т-клеток подвергается элиминации, важным механизмом которой является активационно-индуцированная гибель клеток. Она реализуется через активацию апоптоза лимфоцитов по Fas-зависимому пути, который развивается при взаимодействии трансмембранного Fas (CD95) с его лигандом.
В подгруппе пациентов с неблагоприятным исходом острого периода ИИ абсолютное содержание лимфоцитов и CD3+ лимфоцитов на 7-е сутки наблюдения достоверно увеличивалось, а к 21-м суткам оно достоверно понижалось. Таким образом, на 7-е сутки исследования в периферической крови у пациентов этой подгруппы было максимальное значение вышеуказанных параметров. Это указывает на пик специфического иммуногенного ответа на 7-е сутки, в отличие от «провала» его в подгруппе благоприятного исхода (рис. 4). Это происходило на фоне достоверного и гораздо более мощного, чем в подгруппе благоприятного исхода, повышения концентрации ИЛ-6, который играет важную роль в развитии адаптивного иммунного ответа за счет стимуляции выработки специфических антител и эффекторных Т-клеток [17]. Различия концентрации ИЛ-6 между подгруппами были достоверными. При этом выявлялись достоверные корреляционные связи между абсолютным содержанием лимфоцитов и CD3+ лимфоцитов на 7-е сутки и выраженностью неврологического дефицита как на том же сроке исследования, так и в исходе острого периода ИИ. Для абсолютного содержания CD3CD95+ лимфоцитов была характерна динамика, противоположная таковой для лимфоцитов. К 7-м суткам исследования минимальное абсолютное содержание CD3CD95+ лимфоцитов обусловливало низкий уровень их апоптоза. Также этому способствовало и повышение концентрации ИЛ-6, который может ингибировать развитие апоптоза Т-лимфоцитов.

С учетом приведенных выше данных сформулирована рабочая гипотеза о том, что популяция CD3CD95+ лимфоцитов может выступать буфером для растворимого sFasL и влиять на эффективность его взаимодействия с рецепторами на поверхности клеток, в том числе и нейронов головного мозга. «Емкость» этого буфера связана и отражает интенсивность специфического иммунного ответа. В связи с этим был разработан новый показатель, отражающий «емкость буфера» системы Fas, – sFasL-эффективность. Он рассчитывался как отношение в периферической крови концентрации sFasL к произведению концентрации sFas и абсолютному содержанию CD3CD95+ лимфоцитов. В острейшем периоде ИИ этот показатель не коррелировал ни с тяжестью неврологического дефицита, ни с темпом его восстановления и не был связан с показателями системного воспалительного ответа. На 7-е сутки исследования наблюдалась иная картина: данный показатель коррелировал с баллом по NIHSS (r=0,244, p <0,05), темпом восстановления (r=-0,310, p <0,05), концентрациями ИЛ-6 (r=0,570, p <0,01) и TNF-α (r=-0,222, p <0,05), содержанием лимфоцитов (r=- 0,222, p <0,05) и CD3+ лимфоцитов (r=-0,757, p <0,01). Это дает основание предполагать, что на 7-е сутки после ИИ основная роль регулирующих апоптоз факторов в патогенезе острого периода ИИ сопряжена с регуляцией аутоагрессивного иммунного ответа.
Величина показателя sFasL-эффективности периферической крови при остром ИИ была достоверно ниже во все сроки исследования, чем в группе контроля (p <0,01). Видимо, после развития ИИ, несмотря на достоверное повышение концентрации sFasL, эффективность взаимодействия этих лигандов со своими трансмембранными рецепторами и соответственно их патофизиологический и клинический эффект могут регулироваться через вышепредставленный механизм.
На фоне этого в подгруппах с благоприятным и неблагоприятным исходами острого периода ИИ отмечались различия динамики для показателей обеих регулирующих апоптоз систем (рис. 5). В подгруппе с благоприятным исходом на 7-е сутки исследования происходило снижение, а с неблагоприятным – увеличение показателя sFasL-эффективности (p <0,01). При ретроспективном анализе выявлялась его прогностическая значимость (r=-0,473, p <0,01). К 21-м суткам при благоприятном исходе показатель парадоксально увеличивался, а при неблагоприятном, наоборот, уменьшался (p <0,01).
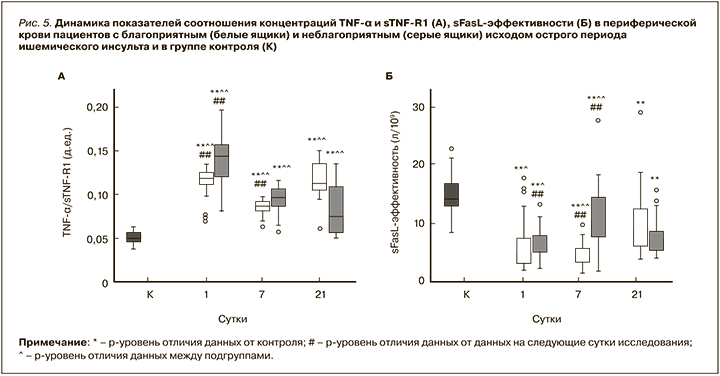
Соотношение концентраций растворимых лигандов и рецепторов обеих рассматриваемых регулирующих апоптоз систем достоверно возрастало к исходу острого периода ИИ по сравнению с 7-ми сутками в подгруппе пациентов с благоприятным исходом, тогда как на 1-е сутки высокие значения этого параметра соответствовали плохому прогнозу (p <0,01).
ЗАКЛЮЧЕНИЕ
Таким образом, роль регулирующих апоптоз лиганд-рецепторных соотношений в патогенезе острого периода ИИ зависит от времени, прошедшего с момента манифестации, и определяет его исход. В острейшем периоде преимущественное направление регуляции сопряжено с локальным и системным воспалительным ответом, в исходе острого периода – с реализацией адаптивных саногенетических механизмов и процессов нейропластичности, обеспечивающих благоприятный исход острого периода ИИ. В острейшем периоде ИИ разделение исследованных БАВ на провоспалительные и апоптозиндуцирующие крайне условно и лишь отражает их принадлежность к той или иной искусственно выделенной систематической группе. Эффект их действия не может быть определен вне контекста суммарных условий среды, которые можно обозначить как «запрос системы на адаптацию».
Выводы
1. Для острого периода ИИ характерно закономерное увеличение концентрации в крови растворимых регулирующих апоптоз факторов sFasL, sFas и TNF-α по сравнению с контролем. При этом для растворимых эффекторов системы Fas свойственно прогредиентное нарастание их концентрации в течение всего острого периода, а для эффекторов системы TNF-α – более сложная разнонаправленная динамика.
2. Соотношение уровней растворимых регулирующих апоптоз рецепторов и лигандов в крови при поступлении пациента с ИИ в стационар целесообразно использовать для прогноза исхода его острого периода. При соотношении концентраций sFasL/sFas меньшем или равном 2,41±0,26 прогнозируют уменьшение неврологического дефекта до 5 баллов и ниже по шкале NIHSS в течение острого периода ИИ (благоприятный исход). При соотношении концентраций sFasL/sFas в крови более 2,41±0,26 прогнозируют развитие неблагоприятного исхода (неврологический дефект свыше 5 баллов по шкале NIHSS).
3. Эффекты и значение регулирующих апоптоз лиганд-рецепторных взаимодействий в патогенезе ИИ зависят от времени, прошедшего с момента его манифестации. В острейшем периоде заболевания роль механизмов регуляции сопряжена преимущественно с развитием локального и системного воспалительных ответов, а в исходе острого периода – с доминированием адаптивных механизмов и процессов нейропластичности.


