ВВЕДЕНИЕ
Остеоартрит (ОА) остается самым распространенным хроническим заболеванием опорно-двигательного аппарата и одной из ведущих причин инвалидизации в мире [1–4]. Следует отметить, что ОА является гетерогенной группой патологических состояний с различной этиологией, а также схожими морфологическими, клиническими проявлениями и исходом [3–6]. В основе заболевания лежит поражение всех структур сустава: мышц, связок, капсулы, синовиальной оболочки, хряща и субхондральной кости [3–7]. В формировании и прогрессировании ОА важная роль принадлежит полу, возрасту, гормональному статусу, особенностям внешней среды, генетическим и иммунологическим факторам, а также низко интенсивному воспалительному процессу (low-grade inflammation) [3–11]. По различным данным, в настоящее время ОА во всем мире страдают около 528–654 млн человек [1–4], при этом почти 10% мужчин и 14% женщин в возрасте 50–69 лет наблюдаются с симптоматическим ОА тазобедренных и коленных суставов (КС) [4].
В России только с 2000 по 2010 число больных ОА возросло почти в 2,5 раза [12], а согласно последним данным, распространенность заболевания в популяции составляет 13% [13]. В следующие несколько десятилетий прогнозируется резкий подъем частоты встречаемости ОА в мире, что объясняется увеличением продолжительности жизни и растущим бременем ожирения [14].
Гиперурикемия (ГУ) – повышение уровня мочевой кислоты (МК) в сыворотке крови более 420 мкмоль/л у мужчин и 360 мкмоль/л у женщин. При несоответствии клинической картины пациента с повышением МК в сыворотке крови диагностическим критериям подагры ACR/EULAR 2015 г. [15] и/или критериям острого подагрического артрита S. Wallace 1997 г. [16] ГУ считается бессимптомной. В соответствии с клиническими рекомендациями Ассоциации ревматологов России по диагностике и лечению подагры [17] выделяют две последовательные стадии бессимптомной ГУ: с отсутствием депозитов моноурата натрия (МУН) и с наличием депозитов МУН, но без симптомов или анамнеза подагры (отсутствие приступов артрита и тофусов). За последние два десятилетия наблюдается тенденция к более широкой распространенности ГУ [18, 19], что прежде всего связывают с нарастанием гиподинамии и частоты метаболических нарушений, а также избыточным потреблением в пищу продуктов питания, богатых пуринами (мясо, морепродукты), сладких безалкогольных напитков и алкоголя [20–22]. Распространенность ГУ в России составляет 16,8% [19].
Несмотря на тот факт, что стойкое повышение МК в сыворотке крови выступает основным этиологическим фактором возникновения подагры, далеко не у всех пациентов с бессимптомной ГУ дебютирует артрит, даже при возможном формировании депозитов МУН в области суставов или сухожильно-связочного аппарата. Так, по данным наблюдательных исследований, кумулятивная заболеваемость подагрой не превышает 49% при уровне МК более 600 мкмоль/л [23, 24].
Ввиду высокой распространенности и наличия общих факторов риска сочетание у пациента ОА с ГУ – нередко встречающаяся клиническая ситуация. В литературе имеются сообщения о возможном взаимном негативном влиянии обоих состояний на функциональные способности опорно-двигательного аппарата, хотя количество проведенных исследований по этой проблеме остается недостаточным [25, 26].
Известно, что целью лечения ОА является устранение боли и воспаления в суставах, улучшение их функциональных возможностей и качества жизни пациентов [1, 3, 4–6, 27, 28]. Основными медикаментозными средствами для достижения этих целей служат местные и системные формы нестероидных противовоспалительных препаратов (НПВП), локальные формы глюкокортикоидов (ГК), препараты гиалуроновой кислоты для инъекционной терапии, опиоидные анальгетики, а также симптоматические лекарственные средства замедленного действия (SYSADOA) [27, 28]. Одним из препаратов группы SYSADOA является биоактивный концентрат мелких морских рыб (БКММР, Алфлутоп®) для парентерального введения, содержащий сульфатированные гликозаминогликаны (хондроитин-4-сульфат, хондроитин-6-сульфат, дерматансульфат, кератансульфат), аминокислоты, пептиды, ионы натрия, калия, кальция, магния, железа, меди и цинка [29].
Целью настоящего исследования стала оценка симптом-модифицирующего эффекта комбинированной терапии, включающей инъекционный курс БКММР (Алфлутоп®) и комплексную уратснижающую терапию (УСТ) у больных ОА с бессимптомной ГУ.
МАТЕРИАЛ И МЕТОДЫ
В ходе проспективного рандомизированного одноцентрового исследования, выполненного на базе СПб ГБУЗ «Клиническая ревматологическая больница № 25», была проведена оценка влияния комбинированной терапии, включавшей нефармакологические и медикаментозные методы лечения ОА в сочетании с бессимптомной ГУ, на динамику снижения уровня МК в сыворотке крови обследованных пациентов, интенсивности болевого синдрома в области суставов по визуально-аналоговой шкале (ВАШ), а также потребности в приеме НПВП. Все пациенты были включены в исследование после подписания информированного согласия, а затем рандомизированы методом конвертов в две группы наблюдения.
Критерии включения в исследование: диагноз ОА, верифицированный в соответствии с критериями ACR и подтвержденный рентгенологическим исследованием, вне зависимости от локализации и стадии патологического процесса; наличие бессимптомной ГУ в анамнезе и/или на момент осмотра (уровень МК в сыворотке крови выше 360 мкмоль/л у женщин и выше 420 мкмоль/л у мужчин, зарегистрированный не менее двух раз); возраст пациентов от 18 до 70 лет на момент включения в исследование.
Критериями исключения служили возраст младше 18 и старше 70 лет; соответствие клинической картины пациента с ГУ диагностическим критериям подагры ARC/EULAR 2015 г. [15] и/ или острого подагрического артрита S. Wallace 1997 г. [16]; вторичный генез ГУ (миело-/лимфопролиферативные заболевания, кожный псориаз и др.); беременность или период лактации; тяжелая патология сердечно-сосудистой системы со значимой степенью недостаточности кровообращения; хроническая сердечная недостаточность III и IV функциональных классов по NYHA; нестабильная стенокардия; стенокардия напряжения III и IV функциональных классов; тяжелая патология печени и органов желудочно-кишечного тракта в стадии обострения; хроническая болезнь почек в стадии терминальной почечной недостаточности. Наряду с этим в исследование не включались пациенты с непереносимостью компонентов, входящих в состав БКММР (Алфлутоп®).
Всего в исследовании приняли участие 55 пациентов в период с января 2020 по декабрь 2022 г. В первый этап исследования вошло 50 пациентов – 27 (54%) женщин и 23 (46%) мужчины, разделенных на две сопоставимые по полу, возрасту и длительности ГУ группы, соответствующие критериям включения/исключения. Средний возраст обследованных составлял 52,6±10,2 [Me=53 (49; 61)] года. Женщины были старше мужчин: 57,2±6,4 [Me=58 (52; 62)] против 47,1±11,2 [Me=49 (39; 54)] лет (p <0,001).
В комплексную терапию ОА у пациентов первой группы (n=25) был включен БКММР (Алфлутоп®) по схемам: по 1 мл внутримышечно, ежедневно № 20, либо по 2 мл внутримышечно, через сутки № 10. Пациенты второй группы (n=25) получали стандартный курс препаратов из группы пероральных SYSADOA: диацереин в капсулах по 50 мг 1–2 раза/ сут, либо Пиаскледин (неомыляемые соединения – масло авокадо и масло соевых бобов) в капсулах по 300 мг/ сут, либо глюкозамина сульфат в форме порошка по 1500 мг/ сут, либо капсулы, содержащие глюкозамина гидрохлорид (500 мг) + хондроитина сульфат (400 мг) по 2–3 раза/сут (табл. 1).
На следующем этапе исследования была проведена сравнительная оценка симптом-модифицирующего эффекта комбинированной терапии, включавшей инъекционный курс БКММР (Алфлутоп®) и комплексную УСТ, в зависимости от длительности наблюдения. Для выполнения этой задачи было обследовано 30 пациентов, разделенных на две сопоставимые по полу, возрасту и длительности ГУ группы. Пациенты, включенные в первую группу (n=15), наблюдались в течение 4,1±0,96 (от 3 до 6) мес, тогда как участники из второй группы (n=15) проходили динамическое наблюдение на протяжении 8,3±0,8 (от 7 до 9) мес (табл. 2).
На этапе включения в исследование у всех пациентов из комплексной терапии исключались препараты, способствующие повышению уровня МК в сыворотке крови (диуретики, низкие дозы ацетилсалициловой кислоты и др.). На каждом из визитов осуществлялись сбор жалоб и анамнеза, оценка интенсивности болевого синдрома, потребности в приеме НПВП, переносимости проводимой терапии, динамики лабораторных показателей, а также объективный осмотр для определения суставного статуса. Целевым уровнем МК в сыворотке крови считались значения от 300 до 360 мкмоль/л, вне зависимости от пола.
Нефармакологическая терапия включала соблюдение диеты с ограничением продуктов, богатых пуринами, алкоголя и сладких безалкогольных напитков, содержащих фруктозу. Всем участникам исследования были даны рекомендации по объему и интенсивности физических нагрузок, а также проведено персонифицированное обучение лечебной физкультуре (ЛФК). При отсутствии противопоказаний выполнялись курсы физиотерапевтических процедур в соответствии с рекомендациями врача-физиотерапевта. УСТ проводилась при стойко повышенном уровне МК и наличии высокого сердечно-сосудистого риска. При наличии выраженного болевого синдрома и/или воспалительных изменений в области суставов, а также в отсутствие противопоказаний у пациентов обеих групп применялась курсовая (5–14 сут) терапия НПВП (эторикоксиб 60–90 мг/сут, либо целекоксиб 200 мг/сут, либо нимесулид 200 мг/сут, либо мелоксикам 15 мг/сут, либо ацеклофенак 200 мг/ сут) и/или локальная терапия ГК (раствор бетаметазона 1 мл). Наряду с этим, группы были сопоставимы по частоте применения локальной терапии ГК (p ≥0,05).
Статистический анализ данных производился с использованием пакета программного обеспечения STATISTICA 8.0 (StatSoft Inc, США). Характер распределения данных оценивался графическим методом и с использованием теста Шапиро–Уилка. Признаки описывались в виде среднего значения (M) ± стандартное отклонение (SD) и/или медианы (Ме) с указанием интерквартильного размаха (25-й (Q1) и 75-й (Q3) процентили). При нормальном распределении признака различия определялись посредством критерия Стьюдента. При распределении данных, отличных от нормального, применялись критерии Манна–Уитни и Уилкоксона. Для выявления динамики зависимых номинальных показателей использовался тест Кохрена. Различия и взаимосвязи между полученными данными считались статистически значимыми при p <0,05.
РЕЗУЛЬТАТЫ
Исходно пациенты, включенные в исследование, были сопоставимы по клиническим проявлениям суставного синдрома (табл. 3).
После проведенного курса комбинированной терапии у пациентов обеих групп наблюдалась значимая (p <0,001) положительная динамика течения ОА в виде снижения количества болезненных суставов. При этом у пациентов первой группы отмечалось достоверное снижение показателей по визуально-аналоговой шкале (ВАШ) боли (p=0,000071), в то время как у обследованных лиц из второй группы уменьшение этого параметра не достигало статистической значимости (p=0,055927). Полученные данные представлены в таблице 4.
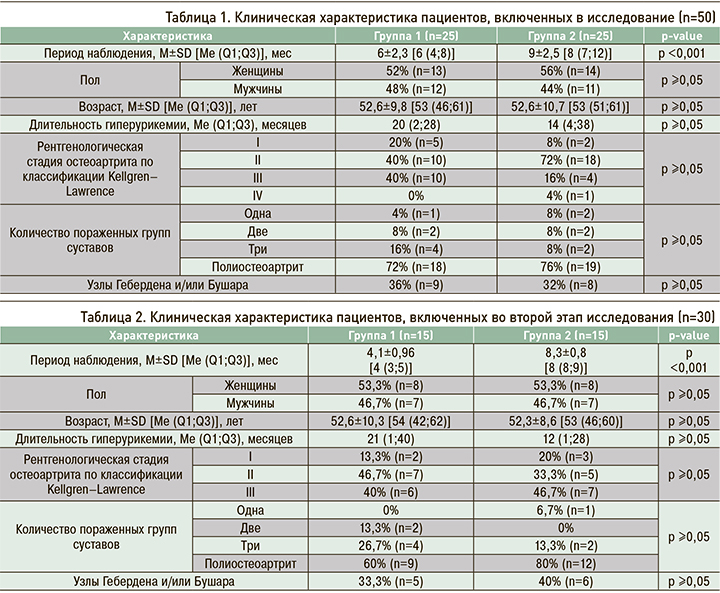
Исходно 76% (n=19) пациентов первой группы и 68% (n=17) обследованных второй группы нуждались в приеме НПВП (p ≥0,05). В результате проведенного комбинированного лечения с применением БКММР (Алфлутоп®) в первой группе участников исследования отмечалось снижение этого показателя на 73,7% (p=0,000183). При этом в группе пациентов, получавших курс пероральных SYSADOA, уменьшения дозы НПВП удалось достичь лишь в 58,8% (p=0,001566) случаев (рис. 1).
Медикаментозная УСТ проводилась у 76% (n=19) пациентов первой группы и у 60% (n=15) второй (p≥0,05; табл. 5). Следует отметить, что у 24% (n=6) пациентов из группы Алфлутопа и у 8% (n=2) из группы пероральных SYSADOA во время первичного осмотра наблюдалась нормоурикемия на фоне ранее проведенных или проводимых на момент включения в исследования терапевтических мероприятий.
На момент включения в исследование у пациентов второй группы отмечались более высокие уровни МК в сыворотке крови (p=0,016979). Проведение комплексной терапии привело к значимому снижению концентрации МК в сыворотке крови у наблюдаемых лиц из обеих групп. При этом достижение или сохранение целевых значений данного показателя в сыворотке крови достоверно (р=0,022438) чаще отмечалось у пациентов первой группы (60%; n=15) по сравнению со второй (28%; n=7; табл. 6).
В ходе внутригруппового анализа 30 пациентов, получавших инъекционный курс БКММР (Алфлутоп®), было установлено, что положительная динамика течения ОА наблюдалась у них как после 6-месячного, так и 9-месячного периода наблюдения. Однако снижение ВАШ боли не достигало статистической значимости в точке наблюдения, соответствующей 7–9-му месяцам исследования (p=0,065288). Данные проведенного анализа приведены в таблице 7.
Исходно потребность в приеме НПВП в связи с наличием болевого синдрома отмечалась у 73,3% (n=11) пациентов первой группы и у 86,7% (n=13) лиц, включенных во вторую группу (p ≥0,05). Проведение курса комбинированной терапии, включающей инъекционный курс БКММР (Алфлутоп®), приводило к снижению данного показателя на 72,7% (p=0,004678) через 3–6 мес и на 61,5% (p=0,004678) через 7–9 мес наблюдения. Полученные данные показаны на рисунке 2.
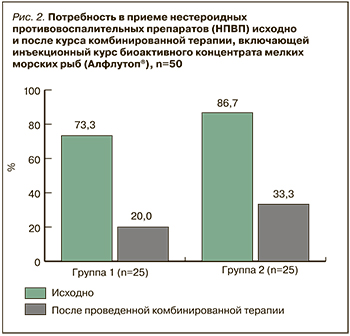
В ходе выполненного исследования не было зарегистрировано нежелательных явлений при проведении лечения БКММР (Алфлутоп®) как в режиме монотерапии, так и в сочетании с НПВП и/или локальными ГК и/или уратснижающим препаратом (аллопуринолом).
ОБСУЖДЕНИЕ
Известно, что исследования, посвященные изучению особенностей течения ОА на фоне ГУ, остаются явно недостаточными и требуют целого ряда уточнений не только патогенетических механизмов, но и выделения особых гетерогенных форм ОА. Одна из первых публикаций на эту тему была представлена Simkin P.A. et al. в 1983 г., в которой авторы обнаружили связь между узловой формой ОА и дебютом подагрического артрита суставов кистей. Исследователями была высказана гипотеза, что ранее поврежденная поверхность суставного хряща может служить местом агрегации кристаллов МУН [30]. На основании результатов этого и других подобных наблюдений была разработана модель совместного течения ОА и ГУ, в соответствии с которой конечный исход их взаимодействия приводит к формированию «порочного круга», провоцирующего и усугубляющего течение обоих патологических процессов [25, 26].
В публикациях последних лет приводятся данные о том, что воспаление при ОА, вызывающее повреждение тканей суставов, может сопровождаться и развитием ГУ. Оказалось, что массивный апоптоз хондроцитов способствует образованию МУН, который при определенных условиях может подвергаться кристаллизации и приводить к механическому повреждению и/или увеличению выраженности воспалительного процесса, что потенцирует дальнейшее прогрессирование ОА. Более того, кристаллы уратов способны активировать хондроциты, находящиеся рядом с поврежденными зонами хряща, к повышенному синтезу протеаз и провоспалительных цитокинов, что создает условия для прогрессирования структурных проявлений ОА [25].
По современным представлениям, имеются четыре варианта возможных патологических связей между ОА и ГУ [25, 26].
1. Независимое друг от друга течение.
2. Наличие общих факторов риска без прямой взаимосвязи.
3. Ранее существовавший ОА способствует локальной кристаллизации МУН, его депонированию и в конечном итоге увеличивает риск дебюта подагры.
4. Депозиты МУН в области суставов вызывают локальное повреждение и воспалительный процесс, которые располагают к развитию и прогрессированию ОА.
Общие факторов риска развития ОА и ГУ включают пожилой возраст, ожирение и наличие других метаболических нарушений [8, 11, 20, 31, 32]. Следовательно, проведение немедикаментозной терапии, направленной на устранение гиподинамии, избыточного веса, гипергликемии и дислипидемий, в том числе соблюдение лечебных диет, может оказать положительный эффект в отношении течения как ОА, так и ГУ.
Согласно одной из гипотез, хондроциты способны экспрессировать переносчики МК на своей плазматической мембране, что указывает на их возможную роль в поглощении растворимых уратов [33]. По другой гипотезе, синовиальная оболочка при ОА становится более проницаемой для воды, чем для МК, что влечет за собой относительное увеличение ее концентрации в синовиальной жидкости [25, 34].
Нарушение анатомической целостности суставного хряща любого генеза может служить фактором развития ОА. Так, механическое повреждение и/ или воспалительная реакция, возникающие на фоне достижении высокой концентрации МК и депонирования кристаллов МУН, выступают субстратом для разрушения структур сустава. Кристаллизация уратов на микроскопическом уровне может активировать хондроциты, стимулируя выработку большего количества протеаз и цитокинов [25]. Более того, имеются данные, демонстрирующее непосредственное влияние кристаллов МУН на жизнеспособность клеток сустава [35–37]. Помимо приведенных данных, наличие кристаллов и депозитов МУН тесно связано с повреждением хряща, что может подтверждать их механический эффект, ответом на который становится активация синтеза интерлейкина (ИЛ)-1β, фактора некроза опухоли-альфа, простагландинов, матриксной металлопротеиназы (ММП)-3 и ММП-13, аггреканаз, оксида азота и других биологически активных частиц [35, 38–41]. Кристаллы МУН имеют свойство вступать в связь с Toll-подобными рецепторами (TLR) 2/4 и корецептором CD14, что инициирует воспалительный процесс в синовиальной оболочке и деструкцию суставного хряща за счет повышения продукции ИЛ-6, ИЛ-18 и ИЛ-1β [37, 44–48]. Эти взаимосвязи подтверждаются исследованием пациентов с ОА КС, где было показано, что уровень МК в синовиальной жидкости был прямо связан с уровнями ИЛ-1β и ИЛ-18, а также с тяжестью поражения суставов при отсутствии подагры [44]. При этом показано, что при низких концентрациях МК в сыворотке крови наблюдается снижение синтеза ММП, оксида азота, циклооксигеназы и скорости прогрессирования ОА [49]. Большим количеством исследований показано, что до 42% пациентов с бессимптомной ГУ имеют признаки депонирования кристаллов МУН, в том числе и в виде тофусов [50, 51]. Подобные результаты позволяют рассматривать бессимптомную ГУ как возможный фактор механического повреждения тканей суставов.
Массивные отложения кристаллов МУН в виде тофусов в области суставов являются еще одним фактором риска возникновения и прогрессирования ОА [52]. Целым рядом крупных исследований подтверждается тот факт, что в суставах (особенно в области первых плюснефаланговых суставов стоп, КС и дистальных межфаланговых суставов кистей), вовлеченных в острый подагрический артрит, в дальнейшем чаще развиваются симптомы ОА [26, 44, 53–57]. При обследовании 164 пациентов с подагрой было продемонстрировано, что в суставах, в которых ранее развивался подагрический артрит, более чем в 7 раз чаще диагностировался ОА [54].
В наблюдательном исследовании, включавшем 39 111 пациентов, было обнаружено, что наличие ОА связано с повышенным риском дебюта подагры (отношение шансов (ОШ) 1,27). С другой стороны, в течение 10 лет наблюдения у пациентов с подагрой отмечалась более высокая вероятность развития ОА (скорректированное отношение рисков (ОР) 1,45) [56]. В свою очередь, в исследовании с участием 119 пациентов было выявлено, что наличие подагры увеличивает шанс выявления ОА КС (ОШ 3,8; 95% доверительный интервал (ДИ): 1,06–13,57; p=0,040) [58]. На основе анализа данных 4685 пациентов в Китае, было установлено, что повышенный уровень МК ассоциируется с наличием остеофитов в области КС у лиц женского пола [59]. Показано, что увеличение МК может служить предиктором сужения рентгенографической суставной щели при ОА КС [60]. Наконец, у больных ОА с ГУ при магнитно-резонансной томографии КС чаще определяется развитие эрозий, остеофитов, поражение костного мозга, увеличение толщины и воспалительные изменения синовиальной оболочки по сравнению с лицами с нормоурикемией [61].
Результаты, полученные в ходе проведенного нами исследования и демонстрирующие менее интенсивную положительную динамику суставного синдрома у пациентов второй группы, у которых отмечались более высокие уровни МК в сыворотке крови, могут косвенно свидетельствовать о вероятной роли ГУ в интенсивности болевого синдрома и прогрессировании ОА.
Медикаментозное лечение пациентов с бессимптомной ГУ остается предметом дискуссий среди специалистов различных медицинских сообществ. Вместе с тем большинство исследователей считает, что ГУ имеет прямые связи с риском формирования и прогрессирования заболеваний сердечно-сосудистой системы, почек и метаболических нарушений [62, 63]. Европейское общество по артериальной гипертензии (Borghi C. et al.) [64, 65], а также отечественные исследователи (И.Е. Чазова с соавт.) [66] разработали консенсус по ведению пациентов с ГУ и высоким сердечно-сосудистым риском: в соответствии с ним проведение фармакологической УСТ рекомендовано при неэффективности немедикаментозных методов лечения. Что касается исследований по изучению влияния УСТ на течение ОА у пациентов с ГУ, то в настоящее время их явно недостаточно, хотя Viggiano D. et al. предлагают в качестве рутинного обследования пациентов с бессимптомной ГУ проводить ультразвуковое исследование опорно-двигательного аппарата на предмет определения депозитов кристаллов МУН, выявление которых может быть одним из критериев для инициации УСТ [67].
Основными задачами в лечении ОА являются предупреждение деградации суставного хряща, купирование болевого синдрома и воспалительного процесса [1, 3–6, 27, 28]. Всем пациентам рекомендованы модификация спортивных/физических нагрузок и разгрузка пораженных суставов, абсолютному большинству – регулярные занятия ЛФК для укрепления околосуставных мышц и сухожильно-связочного аппарата. Доказано, что физические упражнения способствуют снижению боли и сохранению функциональной активности суставов. В то же время в случае хронической скелетно-мышечной боли, в том числе при ОА суставов нижних конечностей, ходьба значимо уменьшает симптомы заболевания. Абсолютно всем пациентам рекомендовано снижение веса при наличии избыточной массы тела [1, 3–6, 27, 28]. В качестве медикаментозной терапии ОА наиболее активно применяются НПВП (локальные и системные формы), локальные формы ГК, препараты гиалуроновой кислоты и SYSADOA [27, 28].
Результаты экспериментальных исследований показали, что БКММР (Алфлутоп®) обладает способностью подавлять активность ММП и ADAMTs, блокировать воспалительные пути, что вызывает снижение апоптоза хондроцитов и остеоцитов. Согласно некоторым данным, применение этого препарата может приводить к подавлению синтеза васкулоэндотелиального фактора роста, там самым угнетая прогрессирование неоангиогенеза [29]. В ходе проведенного нами исследования были получены положительные эффекты комплексной терапии у пациентов с ОА и бессимптомной ГУ в виде уменьшения интенсивности боли по шкале ВАШ и количества болезненных суставов, а также потребности в приеме НПВП. В литературе представлены результаты исследований со схожими результатами для пациентов с ОА, вне зависимости от уровня МК в сыворотке крови. Так, Л.И. Алексеева с соавт. продемонстрировали снижение болевого синдрома и потребности в НПВП на фоне применения БКММР (Алфлутоп®) [69]. Е.А. Трофимов с соавт. получили достоверное снижение интенсивности болевого синдрома (по ВАШ и индексу WOMAC) у пациентов с посттравматическим гонартрозом на фоне лечения БКММР (Алфлутоп®) [70]. В нашем исследовании было выявлено, что наибольшая эффективность лечения больных ОА с бессимптомной ГУ наблюдалась в первые 6 мес наблюдения.
Ограничения исследования. Данное исследование является пилотным, изучающим роль комбинированной терапии с включением БКММР (Алфлутоп®) в лечении пациентов с сочетанием ОА и БГУ. Для более детального уточнения роли этой схемы терапии необходимо выполнение крупных рандомизированных контролируемых исследований (РКИ). Перспективным представляется изучение различий в клинической картине больных ОА с бессимптомной ГУ, в зависимости от динамики показателей МК, в том числе и на фоне УСТ.
ЗАКЛЮЧЕНИЕ
Проведение комбинированной терапии, включающей инъекционный курс БКММР (Алфлутоп®) и комплексную УСТ, приводит к снижению выраженности болевого синдрома и потребности в приеме НПВП у больных ОА с БГУ. При этом эффективность терапии более значима в первые 6 мес после начала лечения. Для подтверждения этих выводов необходимо проведение крупных РКИ. Актуальным и перспективным представляется дальнейшее изучение роли бессимптомной ГУ в формировании и прогрессировании патологии опорно-двигательного аппарата, а также влияния УСТ на течение ОА у пациентов с нарушениями пуринового обмена.


