ВВЕДЕНИЕ
Актуальность обсуждения терапевтических опций при сахарном диабете 2-го типа (СД 2) объясняется не только широкой распространенностью и постоянным увеличением количества новых выявляемых случаев этого заболевания, но и его выраженным отягощающим влиянием на различные органы и ткани, высокой вероятностью развития микро- и макрососудистых осложнений, снижением качества и продолжительности жизни пациентов. Бета-ориентированная модель патогенеза СД 2, включающая 11 звеньев, позволила систематизировать сахароснижающие препараты по механизму влияния на каждое из этих звеньев и более основательно подойти к вопросу подбора терапии с точки зрения механизмов развития заболевания [1]. Существующие на сегодняшний день лекарства также можно подразделить на классические, в течение десятилетий зарекомендовавшие себя как эффективные и безопасные средства снижения уровня глюкозы, и инновационные, выделяющиеся своими плейотропными эффектами в отношении сердечно-сосудистой системы, почек, снижения массы тела и рядом других свойств [2].
Широко известно, что у пациентов с СД 2 риски развития заболеваний сердечно-сосудистой системы, почек, глаз и других органов значительно превышают общепопуляционные. Наряду с необходимостью гликемического контроля, особого внимания заслуживает и стратегия профилактики развития осложнений. Отдельный интерес в этом плане представляет группа пациентов с непродолжительным стажем СД 2. В соответствии с алгоритмами специализированной помощи «золотым стандартом» терапии СД 2 считается метформин. Назначение этого лекарственного средства, являющегося представителем группы классических противодиабетических препаратов, обусловлено его умеренным сахароснижающим эффектом, механизмом воздействия на инсулинорезистентность как звено патогенеза СД2, а также плейотропными эффектами в отношении липидного профиля, снижения риска инфаркта миокарда у пациентов с СД 2 и ожирением [3].
Вместе с тем многочисленные исследования демонстрируют, что терапевтическая инертность на ранних этапах СД 2 становится препятствием для достижения желаемого эффекта в отношении профилактики осложнений [4]. Примером исследования, иллюстрирующего преимущество раннего назначения комбинированной терапии метформином и ингибиторами дипептидилпептидазы-4 (иДПП-4) над ступенчатым назначением этих препаратов, служит исследование VERIFY [5]. К инновационным препаратам, наиболее удобным для применения в клинической практике и широко назначаемым в комбинации с метформином, относятся иДПП-4 и ингибиторы натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2). Таблетированные формы этих классов лекарственных средств ассоциируются с отсутствием сложности и дискомфорта при применении пациентами, а широкий спектр плейотропных эффектов позволяет говорить об их кардио- и нефропротективных свойствах, протективном действии в отношении β-клеток поджелудочной железы. Особого внимания заслуживает такое свойство указанных комбинаций сахароснижающих препаратов, как низкий риск гипогликемии, что объясняет их широкое применение у пожилых и функционально зависимых пациентов. Тем не менее в данный момент отсутствуют однозначные рекомендации насчет того, какая из двух комбинаций (метформин + иДПП-4 или метформин + иНГЛТ-2) наиболее предпочтительна для назначения пациентам без сопутствующей патологии (в частности, без заболеваний сердечно-сосудистой системы, почек, ожирения), в связи с чем особый интерес представляет детальное изучение лабораторно-инструментальных показателей пациентов, получающих эти комбинации препаратов.
Предметом активной дискуссии является глюкоцентрическая модель управления СД 2. Первичность контроля гликемии или же профилактики микро- и макрососудистых осложнений у пациентов с СД 2 широко обсуждается представителями различных медицинских специальностей. Известно, что приближение уровня гликированного гемоглобина (HbA1c) к целевым значениям служит залогом профилактики острых и хронических осложнений диабета; это было подтверждено масштабными основополагающими клиническими исследованиями в диабетологии [6]. В то же время ряд других крупных исследований продемонстрировал, что строгий гликемический контроль ассоциирован с повышенным риском гипогликемии [7, 8].
Помимо HbA1c, который отражает средний уровень глюкозы за 3–4 мес, особого внимания заслуживает и такой показатель, как вариабельность гликемии. Результаты многочисленных исследований свидетельствуют, что высокая вариабельность гликемии ассоциирована с окислительным стрессом, эндотелиальной дисфункцией и воспалением, – т.е. с факторами, традиционно связанными с патогенезом микро- и макрососудистых заболеваний [9]. Данные Mendez C.E. et al. позволили сделать вывод о взаимосвязи высокой кратковременной гликемической вариабельности с повышением длительности госпитализации и числа летальных исходов [10]. В исследовании Huang R. et al., целью которого была оценка факторов риска остеопороза у пациентов с СД 2, гликемическая вариабельность была признана одной из предпосылок снижения минеральной плотности костной ткани наряду с такими традиционными факторами риска, как пожилой возраст, наличие дислипидемии, женский пол и повышение индекса массы тела (ИМТ) [11].
Одной из причин высокой вариабельности гликемии может являться тот факт, что некоторые пациенты с СД 2 имеют низкую чувствительность к гипогликемиям. Помимо того что развитие гипогликемического состояния несет непосредственную угрозу жизни пациента, оно также представляет опасность для сердечно-сосудистой системы и выступает барьером для достижения целевой компенсации. В исследовании Bailey T.S. et al. высокая гликемическая вариабельность в течение дня была ассоциирована с повышением риска общих и ночных гипогликемий [12]. В то же время стабилизация гликемической вариабельности приводила к минимизации эпизодов гипо- и гипергликемии [13].
Не менее актуальная проблема современной диабетологии – большое количество пациентов с СД 2, имеющих полиморбидный фон. Среди этой когорты больных широко распространены заболевания сердечно-сосудистой системы, занимающие первое место в статистике смертности [14]. Ряд клинических исследований и метаанализов подтверждает, что гликемическая вариабельность сопряжена с риском макрососудистых осложнений и смертности, независимо от уровня HbA1c [15]. В частности, исследование DEVOTE-2 выявило ассоциацию высокой гликемической вариабельности с риском гипогликемии, MACE и общей смертностью. При этом двукратное возрастание этого параметра было связано с повышением указанных рисков в 2,7, 1,2 и 1,4 раз соответственно [16]. В исследовании Takahashi H. et al. (длительность наблюдения пациентов – 39 мес) был сделан вывод о том, что гликемическая вариабельность выступает независимым предиктором неблагоприятного прогноза у пациентов с СД 2 и острым коронарным синдромом, которым проводилось чрескожное коронарное вмешательство [17]. Однако существует и ряд исследований, отрицающих взаимосвязь гликемической вариабельности и сердечно-сосудистых событий. В частности, исследование HEART2D показало отсутствие различий гликемической вариабельности в группе пациентов, переживших неблагоприятные кардиоваскулярные события, и в группе пациентов без них [18], а исследование FLAT-SUGAR не выявило улучшений в течении аритмий, снижения биомаркеров сердечно-сосудистого риска, уменьшения эпизодов тяжелой гипогликемии по мере уменьшения гликемической вариабельности [19]. В связи с этим особый интерес представляет дальнейшее изучение влияния этого показателя на различные факторы риска у пациентов с СД 2, а также исследование стратегий управления осложнениями заболевания посредством коррекции гликемической вариабельности.
Флеш-мониторинг или непрерывный мониторинг глюкозы (ФМГ или НМГ) в реальной клинической практике показан не всем группам пациентов с СД 2. В частности, у пациентов с целевыми показателями HbA1c, непродолжительным стажем болезни, отсутствием выраженного полиморбидного фона в большинстве случаев нет возможности оценить гликемическую вариабельность. В связи с этим целью нашей работы стало выявление взаимосвязи гликемической вариабельности и клинико-лабораторных характеристик таких пациентов, а также изучение влияния на гликемическую вариабельность различных комбинаций таблетированных сахароснижающих препаратов.
МАТЕРИАЛ И МЕТОДЫ
В исследование вошли 56 пациентов с СД 2 в возрасте от 45 до 60 лет. Длительность заболевания у участников была не более 5 лет, а уровень HbA1c не превышал 7,5%. На этапе включения в исследование со всеми пациентами была проведена беседа о важности соблюдения диеты и регулярной физической активности. Больным была рекомендована терапия одной из комбинаций сахароснижающих средств – метформин + иДПП-4 или метформин + иНГЛТ-2, исходя из того, что обе эти комбинации оптимальны для назначения данной группе пациентов.
Всем участникам исследования проводился ФМГ с помощью системы FreeStyle Libre (Abbott), которую пациент использовал в течение 14 дней. Сканирование датчика осуществлялось пациентом с помощью сканера или личного смартфона, на который предварительно было установлено приложение LibreLink. Данные были получены с помощью приложения для ПК LibreView. Таким образом, в зависимости от получаемой терапии больные были разделены на две группы с целью сравнения особенностей вариабельности гликемии при назначении этих комбинаций сахароснижающих препаратов, что важно в контексте персонализированного подхода в практической медицине.
Данные ФМГ анализировались при помощи общепринятого алгоритма, включающего анализ следующих 5 показателей:
1) качество данных (время активности датчика должно было составлять не менее 70%);
2) время нахождения уровня глюкозы в целевом диапазоне (для всех пациентов он составлял 3,9–10 ммоль/л в соответствии с рекомендациями Международного консенсуса о времени нахождения в целевом диапазоне [20]);
3) гипогликемия (анализировалась частота эпизодов гипогликемии, общая их продолжительность, а также степень этого нарушения);
4) вариабельность гликемии (использовался коэффициент вариабельности);
5) стабильность гликемии (оценивалась по значению ее медианы).
Гликемическая вариабельность оценивалась посредством следующих индексов: MAGE (Mean Average of Glucose Excursions) – средняя амплитуда отклонения глюкозы, включая исключительно изменения более чем на 1 стандартное отклонение в гликемических значениях [21]; стандартное отклонение (SD); индекс длительного повышения гликемии CONGA continuous overlapping net glycemic action) [22]; индекс лабильности гликемии LI [23]; J-index (индикатор качества контроля гликемии, чувствительный как к среднему уровню глюкозы, так и к колебаниям гликемии) [24]; индексы риска гипогликемии и гипергликемии (LBGI, HBGI) [25]; среднее значение суточных различий гликемии (MODD) [26]; среднее суммарное значение рисков (ADRR) [27].
Статистический анализ полученных данных выполнялся с использованием программ Microsoft Office Excel 2016, StatTech v. 3.1.10 (разработчик – ООО «Статтех», Россия), а также Easy GV (разработана исследовательской группой Оксфордского университета, находится в свободном доступе).
Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка (при числе исследуемых менее 50) или критерия Колмогорова–Смирнова (при числе исследуемых более 50). Количественные показатели, имеющие нормальное распределение, описывались через средние арифметические величины (M) и стандартные отклонения (SD), границы 95% доверительного интервала (95% ДИ). В отсутствие нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные представлялись с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, осуществлялось с применением U-критерия Манна–Уитни.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В группу пациентов, получающих комбинированную терапию метформин + иДПП-4, вошел 31, в группу метформин + иНГЛТ-2 – 25 человек. Медиана возраста в 1-й группе составила 55 [52–57], во второй – 56 [54–59] лет. 1-ю группу составили 18 женщин и 13 мужчин, вторую – 12 женщин и 18 мужчин. Медиана ИМТ в группе терапии метформином и иДПП-4 равнялась 31 [29–33], в группе терапии метформином и иНГЛТ-2 – 32 [30–34] кг/м2. По длительности СД 2 обе группы также оказались сопоставимы: в первой группе медиана этого показателя составила 2 [0–4] года, во второй – также 2 [0–5] года. Медиана HbA1c в первой группе была равна 6,1 [5,7–6,6], тогда как во второй – 6,5 [5,7–7,2] %. Таким образом, обе группы пациентов характеризовались относительно компенсированным течением СД 2, непродолжительным стажем заболевания, наличием избыточной массы тела или ожирения I степени, а также были сравнимы по основным клинико-лабораторным характеристикам.
Результаты, полученные при анализе данных ФМГ в зависимости от группы пациентов, представлены в таблице 1.
Статистически значимых различий в группах исследования по представленным параметрам выявлено не было (p >0,05). Среднее время активности датчика оказалось практически идентичным в обеих группах и составило 86±9 (95% ДИ: 83–90) % и 85±9 (95%ДИ: 81–89) % что, во-первых, может свидетельствовать о высокой приверженности пациентов обеих групп ФМГ, а во-вторых, позволяет адекватно и в полной мере интерпретировать полученные данные. Время нахождения глюкозы в целевом диапазоне оказалось выше в группе пациентов, получающих метформин + иНГЛТ-2 (95 [87–97] %), нежели в группе пациентов на терапии метформином + иДПП-4 (91 [84–97] %). Время выше целевого диапазона равнялось 1 [0–2] % в группе метформина и иДПП–4 и 0 [0–4] % в группе метформина и иНГЛТ-2. При этом в обеих группах показатель времени выше 13,9 ммоль/л составил 0 [0–0] %. В отношении времени ниже 3,0 ммоль/л были получены практически идентичные результаты: 0 [0–0] % в группе метформина + иДПП-4 и 0 [0–1] в группе метформина + иНГЛТ-2. Однако при анализе времени ниже целевого диапазона (3,0–3,9 ммоль/л) были получены следующие результаты: в группе, где к метформину был добавлен иДПП-4, пациенты имели данный уровень гликемии в течение 3 [0–12] % времени, а среди пациентов, получающих в дополнение к метформину иНГЛТ-2 – 1 [0–4] % времени.
Количество эпизодов гипогликемии было выше в группе метформин + иДПП-4 (4 [1–16] раз), чем в группе метформин + иНГЛТ-2 (3 [1–8] раз), при этом продолжительность этого состояния в группах составила 126 [45–186] и 90 [30–165] мин соответственно. Таким образом, гликемическая вариабельность, хоть и незначительно, но оказалась выше в группе пациентов, получавших метформин + иДПП-4, чем в группе метформин + иНГЛТ-2, однако при этом ни одно из полученных различий не было статистически значимым.
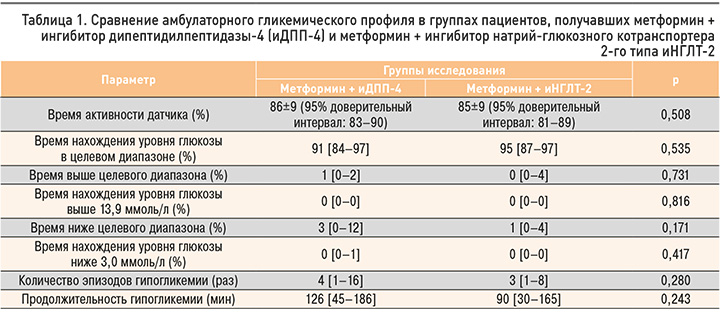
На рисунках 1 и 2 представлены примеры амбулаторного гликемического профиля (АГП) пациенток, получающих терапию метформином + иНГЛТ-2 и метформином + иДПП-4. Примечательно, что в приведенных случаях оказались идентичными показатели HbA1c (5,5% в обоих случаях), среднего уровня глюкозы (5,3 ммоль/л в обоих случаях) и GMI (5,6% в обоих случаях). При этом индекс вариабельности гликемии в первом случае составил 23,4%, а во втором – 26,7%. В отличие от первой пациентки, получающей комбинацию метформин + иНГЛТ-2, у которой время ниже целевого диапазона составило 4%, у второй пациентки, применяющей метформин + иДПП-4, этот показатель достиг 9%, причем 1% от этого времени (14 мин) приходился на уровень гликемии менее 3,9 ммоль/л. Также у второй пациентки 1% времени пришелся на время выше целевого диапазона, но не превышал 13,9 ммоль/л. Таким образом, на примере данных АГП очевидно, что даже малозначимое повышение коэффициента вариабельности может быть ассоциировано с повышением риска гипогликемии и существенно влияет на уменьшение стабильности медианы. Результаты обоих АГП можно считать удовлетворительными, поскольку все показатели соответствуют диапазонам нормальных значений. Тем не менее можно отметить различия, не очевидные при рутинном контроле HbA1c и глюкометрии.
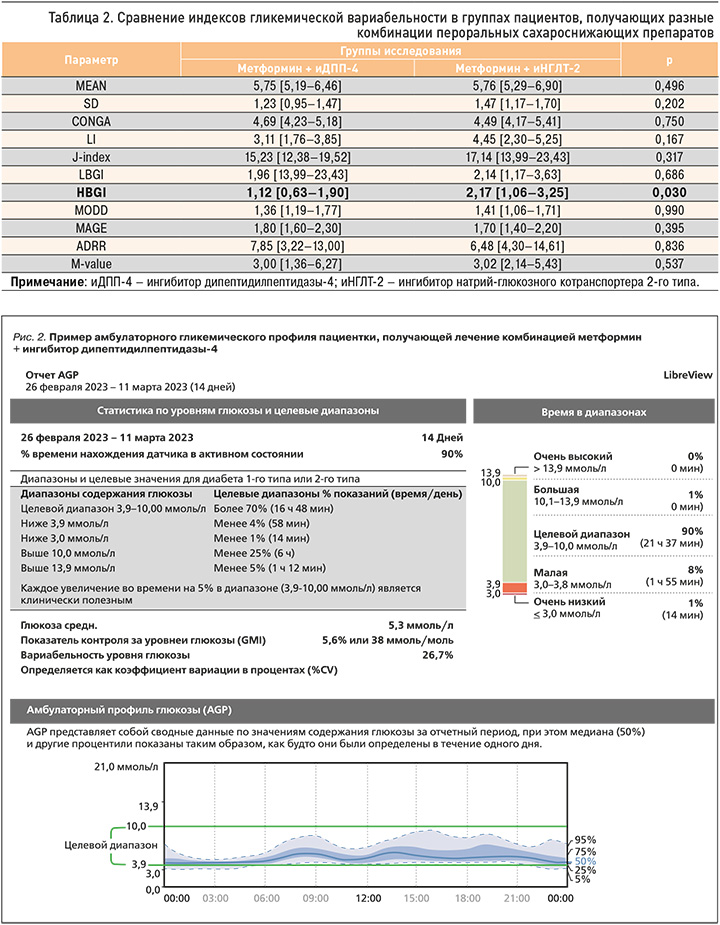
При сравнении индексов гликемической вариабельности в группах пациентов в зависимости от получаемой терапии статистически значимые различия были обнаружены лишь в отношении показателя HBGI (табл. 2). В группе участников, применявших терапию метформином + иНГЛТ-2, этот показатель практически двукратно превышал показатель группы пациентов, получавших метформин и иДПП-4 – 2,17 [1,06–3,25] и 1,12 [0,63–1,90] соответственно (р <0,05). Это свидетельствует о том, что в проанализированной нами выборке у пациентов на терапии метформин + иНГЛТ-2 риск гипергликемии оказался выше, чем у тех, кто получал комбинацию метформин + иДПП-4. Помимо этого, обращают на себя внимание различия, полученные в отношении индекса LI (3,11 [1,76–3,85] и 4,45 [2,30–5,25] в группах метформин + иДПП-4 и метформин + иНГЛТ-2), J–index (15,23 [12,38–19,52] и 17,14 [13,99–23,43] в этих же группах соответственно) и ADDR (7,85 [3,22–13,00] и 6,48 [4,30–14,61]). Такие результаты могут указывать на то, что в группе пациентов, получающих метформин + иНГЛТ-2 гликемию можно считать более лабильной, а качество контроля гликемии менее стабильным, однако суммарные риски, напротив, оказались более высокими в группе больных на терапии метформин + иДПП-4. При этом различия не являлись статистически значимыми (р >0,05). В отношении остальных показателей различия были менее существенными и также не достигли статистической значимости.
ЗАКЛЮЧЕНИЕ
В группе пациентов с непродолжительным стажем СД 2, целевым HbA1c и отсутствием значимых факторов риска рекомендуется назначение комбинации метформина с инновационными сахароснижающими препаратами. Приоритетность назначения комбинации метформин + иДПП-4 или метформин + иНГЛТ-2 не определена и требует дальнейшего изучения и внедрения в алгоритмы лечения пациентов. Исследование гликемической вариабельности у таких пациентов может быть подспорьем в персонализации выбора комбинированной терапии. Управление этим параметром у пациентов с СД 2 является потенциальным механизмом профилактики микро- и макрососудистых осложнений, а также достижения целевой компенсации гликемического контроля и профилактики гипогликемий.



