ВВЕДЕНИЕ
В России сердечно-сосудистые заболевания на протяжении многих лет остаются основной причиной смерти населения: так, по данным официальной статистики за 2020 г., болезни сердца и сосудов унесли жизни более 900 тыс. россиян [1]. Основную часть больных с кардиальной патологией составляют лица с заболеваниями атеросклеротического генеза, при этом с учетом генерализованности процесса с достаточно большой долей вероятности атеросклероз можно диагностировать у исследуемого пациента в разных сосудистых регионах [2].
Следует отметить, что у больных с периферическим атеросклерозом значительно снижается продолжительность жизни, прежде всего за счет развития в отдаленном периоде инфаркта миокарда (ИМ) и ишемического инсульта [3]. При этом ведение пациентов с заболеваниями периферических артерий на амбулаторном этапе обычно не предполагает значительных хирургических вмешательств [4], а больше направлено на построение индивидуальных программ коррекции факторов риска, мониторинга сосудистых нарушений, адекватного патогенетически обоснованного лечения, обеспечивающего в первую очередь улучшение продолжительности и качества жизни [5].
Стратификация риска у такой категории больных крайне важна, поскольку именно она определяет направленность тактики ведения больных групп высокого и очень высокого сердечно-сосудистого риска [6].
С учетом всего вышеизложенного одним из перспективных решений обсуждаемой проблемы в настоящее время является разработка математических моделей прогнозирования риска развития сердечно-сосудистых событий в отдаленном периоде.
Цель исследования – разработка метода прогнозирования развития ИМ у пациентов с периферическим атеросклерозом в отдаленном периоде.
МАТЕРИАЛ И МЕТОДЫ
В работу были включены 519 пациентов (380 мужчин и 139 женщин, средний возраст 60,0±8,7 лет) с атеросклеротическим поражением различных сосудистых регионов и их комбинаций, находившихся на лечении в профильных отделениях ГБУ РО «Ростовская областная клиническая больница». Протокол исследования был одобрен локальным независимым этическим комитетом ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России.
Всем больным проводились стандартные биохимические исследования и комплекс инструментальных исследований, включающий электрокардиографию, эхокардиографическое исследование, ультразвуковое исследование почек, брахиоцефальных артерий (БЦА). При наличии клинических проявлений, вызывающих подозрение на атеросклеротическое поражение сосудистых бассейнов, выполнялись коронароангиография, ангиография почечных сосудов, БЦА и артерий нижних конечностей (АНК) [7].
Анализ данных ангиографического исследования продемонстрировал, что атеросклеротическое поражение одного сосудистого бассейна наблюдалось у 49,7%, двух регионов – у 32,9%, трех – у 16,2%, четырех бассейнов – у 1,2% пациентов.
При этом, согласно результатам коронароангиографии, передняя межжелудочковая ветвь (ПМЖВ) была поражена у большего количества пациентов (69,1%), у которых был верифицирован атеросклероз коронарных сосудов, и средний процент стеноза составил 70,0% [50; 95]. По данным селективной ангиографии почечных артерий (ПА), поражение почечных сосудов было диагностировано у 20,2%, односторонний процесс – у 60,9% пациентов, двустороннее атеросклеротическое поражение ПА – у 39,1% больных. Следует отметить, что среди пациентов с двусторонним стенозом поражение правой ПА >60% было выявлено у 63,4%, а поражение левой ПА >60% – у 43,9% человек.
Анализ особенностей атеросклеротического поражения АНК позволил установить, что у 60,8% пациентов был верифицирован патологический процесс поверхностной бедренной артерии (ПБА) справа, при этом атеросклеротическое поражение ПБА слева было диагностировано у 61,9% больных.
При исследовании особенностей каротидного атеросклеротического поражения отмечено, что чаще патологический процесс верифицировался в области правой внутренней сонной артерии (ВСА, 57,7%) и левой ВСА (58,6%).
Статистическая обработка первичных материалов выполнялась с помощью программ Microsoft Office Excel 2010 и STATISTICA 10.0 (StatSoft Inc.). С целью оценки нормальности распределения количественных показателей в группах нами использовался анализ распределения Колмогорова–Смирнова, при значениях p ≥0,05 распределение значений параметра считалось не отличающимся от нормального, при р <0,05 – отличающимся от нормального.
Описательная статистика в нашей работе включала оценку следующих показателей: в случае нормального распределения параметра в группе определялось среднее его значение в виде M±SD (M – среднее арифметическое, SD – стандартное отклонение), в случае распределения, отличного от нормального, – в виде Me [Q1; Q3] (Me – медиана, Q1 и Q3 – первый и третий квартили). При нормальном распределении параметра в группе, а также при распределении, отличном от нормального, при сравнении двух независимых выборок применялся критерий Манна–Уитни (Вилкоксона), учитывая небольшие размеры групп сравнения. Различия считались статистически значимыми при р <0,05. Для ранговых признаков при анализе связей между признаками использовался критерий Фишера с расчетом χ2. Корреляционный анализ во всех случаях осуществлялся с помощью коэффициента Спирмена. Коэффициент корреляции (r) считали статистически значимым при р <0,05. Также использовался логит-регрессионный анализ с расчетом относительных рисков (OR) и оценкой χ2; при значении р <0,05 связь считалась статистически значимой.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В соответствии с данными литературы, традиционно к признакам, отягощающим прогноз в отношении развития ИМ, относят пол, возраст, наличие стенокардии, перенесенного ранее ИМ, артериальной гипертензии (АГ), сахарного диабета (СД), сердечной недостаточности (СН), избыточной массы тела, повышенного уровня креатинина крови. При наличии у пациента в анамнезе уже имеющегося ИМ, как правило, прогнозируются особо тяжелое течение и летальность, достигающая 50%, а также в 1,5–2 раза меньшая семилетняя выживаемость по сравнению с первичным ИМ [8].
Не вызывает сомнения и тот факт, что объем и характер прогрессирования как коронарного, так и некоронарного атеросклероза также могут выступать довольно важным прогностическим фактором [9].
Факторы, которые, согласно проведенному логистическому регрессионному анализу, оказывали значимое влияние на риск развития ИМ в отдаленном периоде у пациентов группы исследования, приведены в таблице 1.
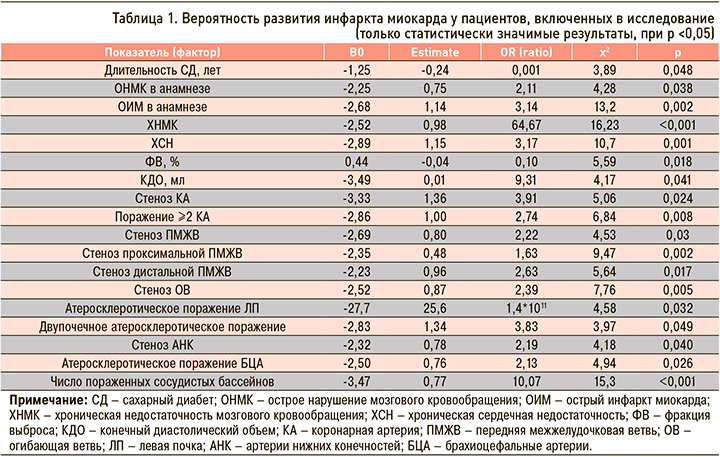
Для статистически значимых признаков была разработана оригинальная номограмма, позволяющая при сопоставлении характеристик факторов получить информацию в отношении отдаленного прогноза, а именно риска развития ИМ (табл. 2).
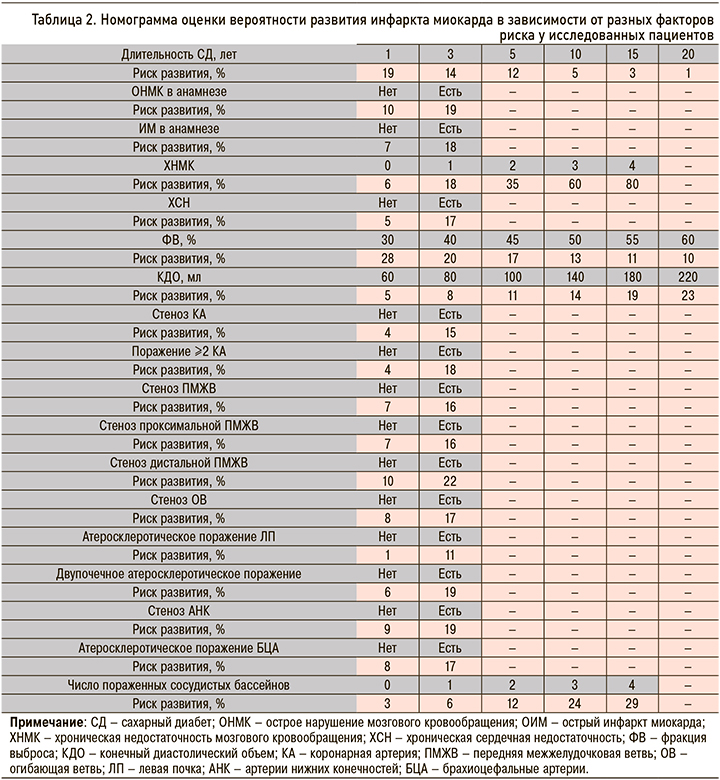
Так, в случае наличия острого нарушения мозгового кровообращения в анамнезе риск развития ИМ в отдаленном периоде составлял 19%, при отсутствии фактора, отягощающего анамнез пациента, – 10%.
При наличии атеросклероза в области БЦА вероятность развития конечной точки составила 17%, при поражении сосудов нижних конечностей – 19%.
Установлено, что по мере увеличения количества пораженных сосудистых бассейнов риск развития ИМ в отдаленном периоде возрастал. К примеру, при атеросклеротическом поражении двух сосудистых регионов вероятность развития обсуждаемой конечной точки достигла 12%, при патологическом процессе в 4 бассейнах – 29%. При этом обращал на себя внимание тот факт, что различные комбинации атеросклеротического поражения при обсуждении вероятности развития ИМ свою статистическую значимость не продемонстрировали.
Согласно результатам ряда исследований, количество пораженных сосудистых бассейнов увеличивает вероятность неблагоприятных исходов: так, смертность у лиц только лишь с изолированной ишемической болезнью сердца была равна 33%, при вовлечении в патологический процесс периферических артерий и аорты этот показатель вырос до 49%, а при поражении трех сосудистых бассейнов и вовсе достиг 59% [10].
В исследовании Lamina C. et al., включившем 1325 бессимптомных пациентов (средний возраст 49,7±14,0 лет), было установлено, что наличие атеросклеротической бляшки как каротидной, так и бедренной локализации, являлось мощным прогностическим фактором смерти от сердечно-сосудистых катастроф [11].
Анализ проведенной бинарной логистической регрессии определил комбинации факторов, продемонстрировавших свою статистическую значимость в отношении точки исследования «фатальный и нефатальный инфаркт». Эти сочетания факторов представлены в таблице 3.
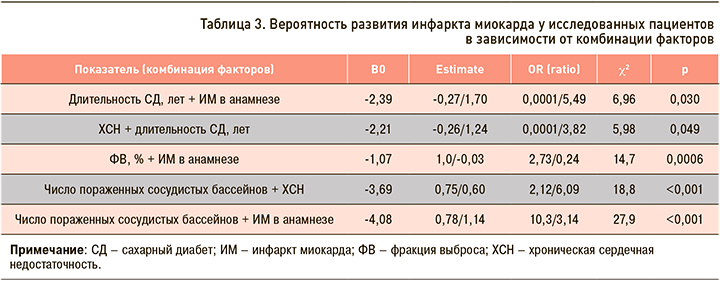
Разработанная нами номограмма позволила оценить вероятность развития ИМ, полагаясь на факторы, которые в проведенном ранее анализе показали свою статистическую значимость (рис. 1, табл. 4). Так, при длительности СД 6 лет и наличии ИМ в анамнезе величина представленного риска составила 16%, тогда как при отсутствии ИМ в анамнезе – 5%
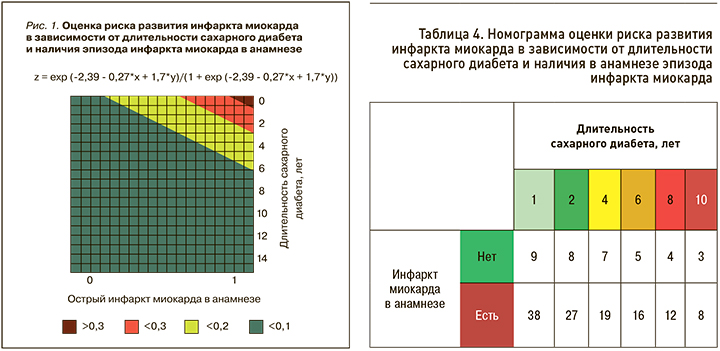
Бинарный логистический регрессионный анализ продемонстрировал аналогичные данные, полученные в ходе однофакторного регрессионного анализа. Например, при большей длительности СД обсуждаемый риск неблагоприятного исхода уменьшался: в случае длительности заболевания 2 года и наличии ИМ в анамнезе этот риск был равен 8%, а при длительности 8 лет и отсутствия в анамнезе у пациента ИМ – 4%. Полученные данные трактуются с той точки зрения, что у представленной группы пациентов при наличии такого комплекса факторов больший процент неблагоприятных отдаленных исходов приходился на такие конечные точки, как фатальная и нефатальная хроническая болезнь почек, фатальный и нефатальный инсульт. В частности, нами установлено, что именно в этих точках исследования при условии большей продолжительности СД риск отдаленных исходов увеличивался.
Анализ следующей составленной номограммы позволил отметить, что при длительности СД, например, 4 года и наличии у пациента ХСН риск развития ИМ в отдаленном периоде составил 20%, у больных без ХСН – 6% (рис. 2, табл. 5).
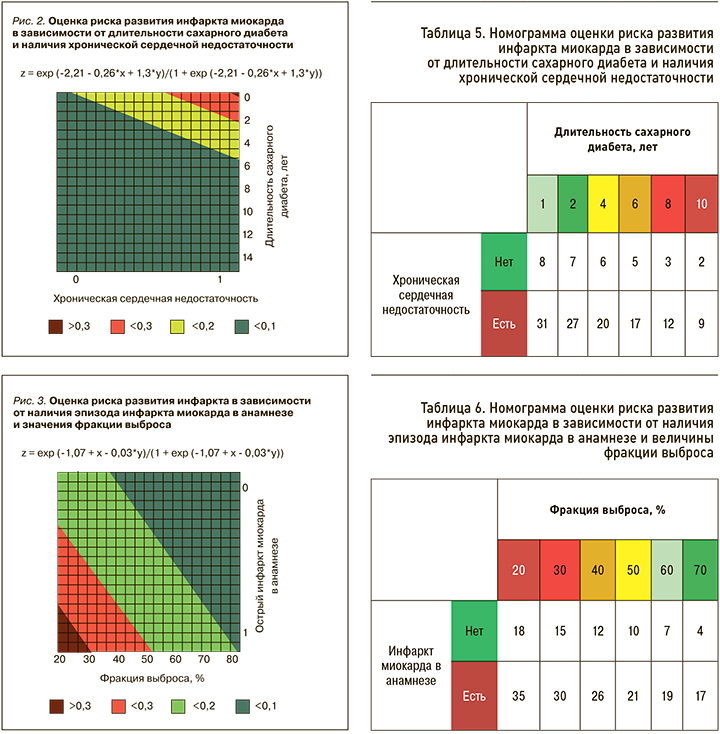
У пациентов с величиной ФВ 50% и наличием ИМ в анамнезе вероятность развития обсуждаемого риска составила 21%, при ФВ 40% риск был существенно выше – 26% (рис. 3, табл. 6).
Номограмма комбинации признаков «число пораженных сосудистых бассейнов + ХСН» наглядно продемонстрировала, что при наличии у пациента стеноза одного сосудистого бассейна + ХСН риск развития обсуждаемой конечной точки составлял 15%, а при атеросклерозе трех сосудистых регионов в сочетании с сердечной недостаточностью – 35% (рис. 4, табл. 7).
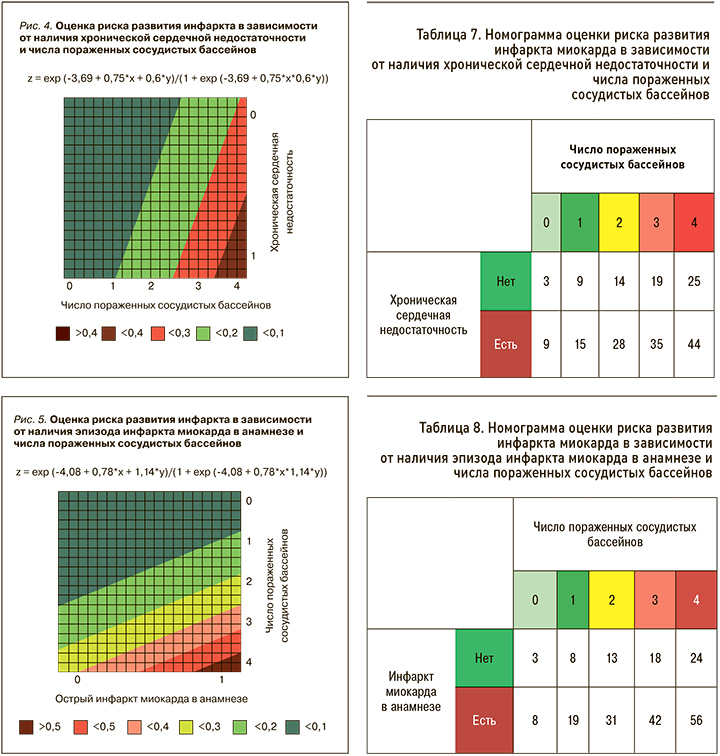
Номограмма, составленная на основе статистически значимого комплекса факторов «число пораженных сосудистых бассейнов + ИМ в анамнезе», показала, что при атеросклерозе двух бассейнов и наличии ИМ в анамнезе риск развития сосудистого эпизода равен 31%, при отсутствии ИМ в анамнезе – 13% (рис. 5, табл. 8).
ЗАКЛЮЧЕНИЕ
Таким образом, в ходе проведенного исследования с использованием современных статистических методов нами были установлены факторы, влияющие на риск развития ИМ в отдаленном периоде у пациентов с периферическим атеросклерозом. Разработанные оригинальные номограммы могут быть использованы в профильных отделениях лечебно-профилактических учреждений с целью оценки неблагоприятного прогноза у больных высокого и очень высокого сердечно-сосудистого риска.



